Chemical Bonding I:
Basic Concepts
Chapter 9
Copyright
© The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
9.1
Valence electrons are the outer shell electrons of an
atom. The valence electrons are the electrons that
particpate in chemical bonding.
1A
1
ns
1
2A
2
ns
2
3A
3
ns
2
np
1
4A
4
ns
2
np
2
5A
5
ns
2
np
3
6A
6
ns
2
np
4
7A
7
ns
2
np
5
Group
# of valence e
-
e
-
configuration
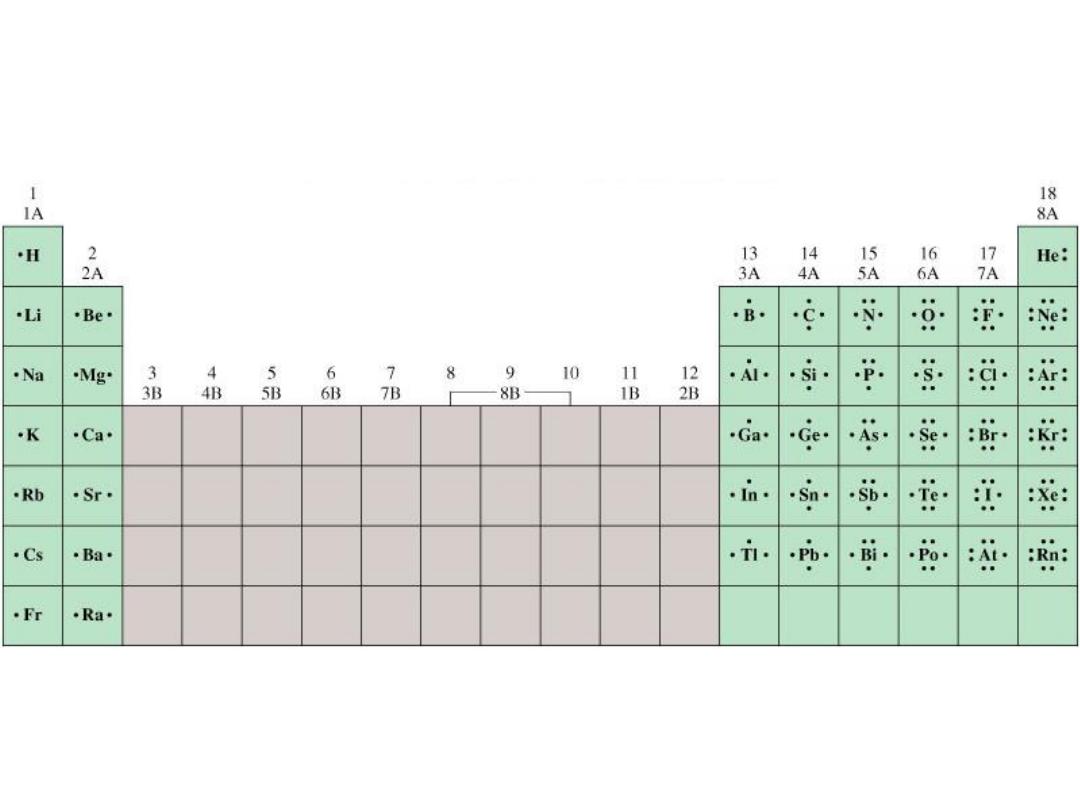
9.1
Lewis Dot Symbols for the Representative Elements &
Noble Gases

9.2
Li + F
Li
+
F
-
The Ionic Bond
1s
2
2s
1
1s
2
2s
2
2p
5
1s
2
1s
2
2s
2
2p
6
Li
Li
+
+ e
-
e
-
+
F
F
-
F
-
Li
+
+
Li
+
F
-
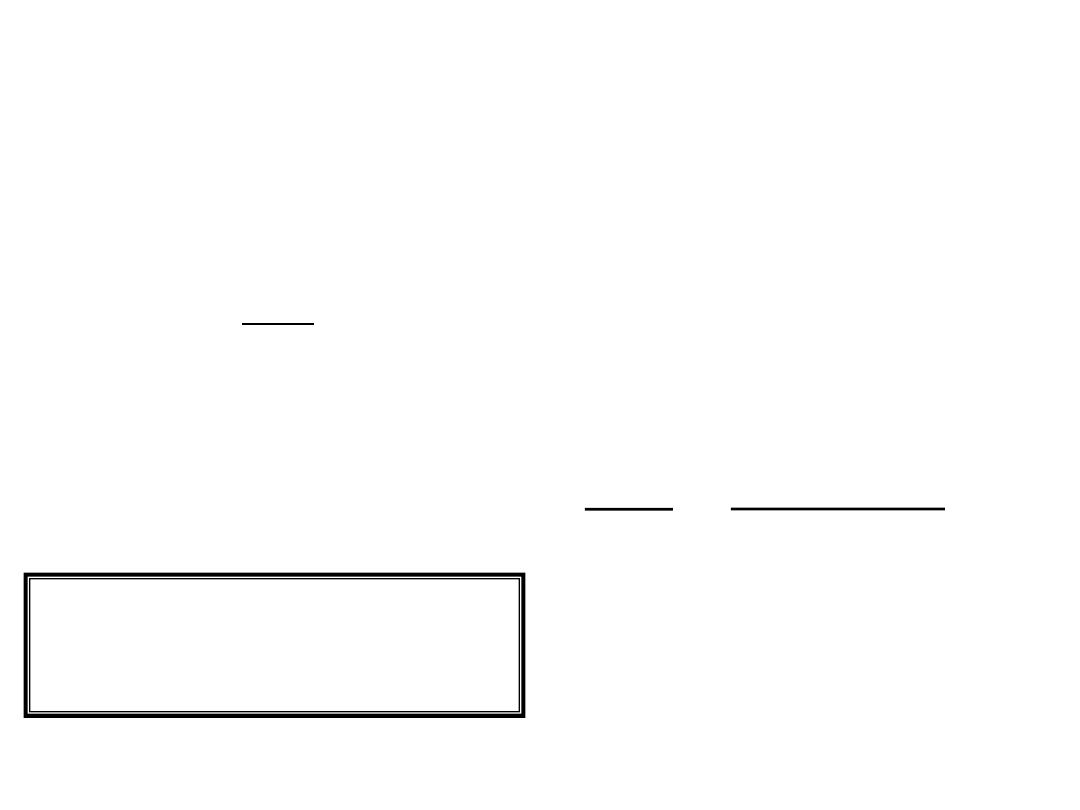
9.3
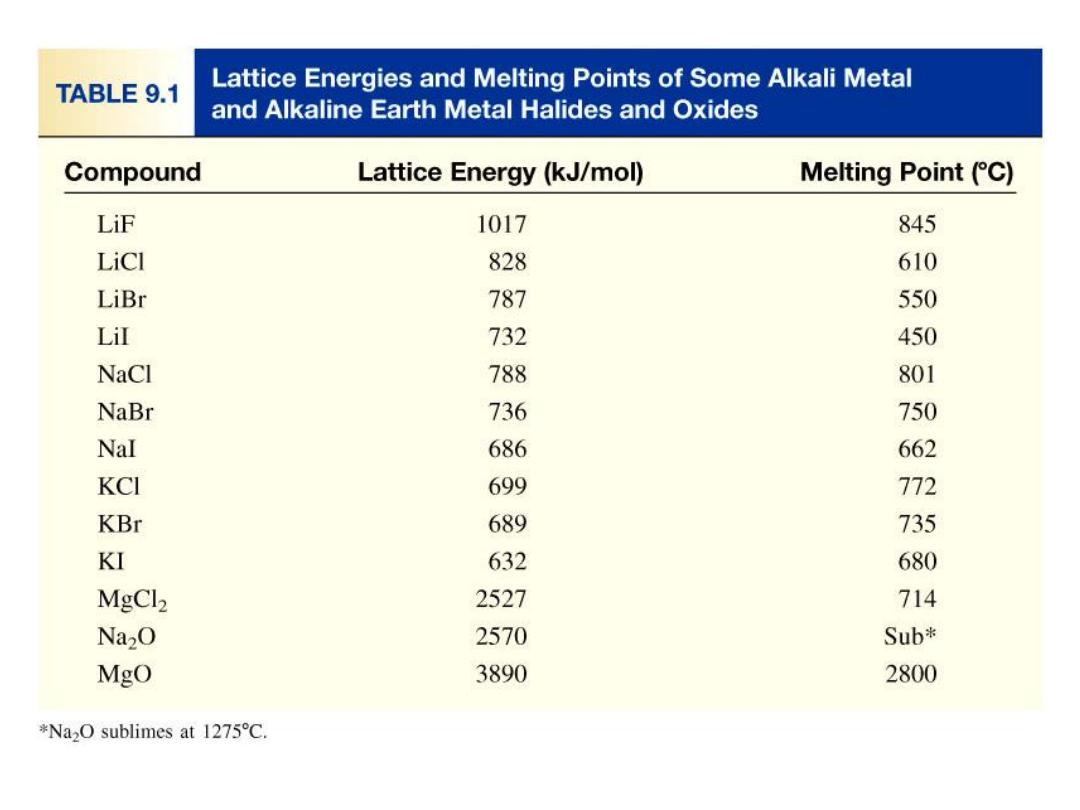
Lattice energy (E) increases
as Q increases and/or
as r decreases.
cmpd
lattice energy
MgF
2
MgO
LiF
LiCl
2957
3938
1036
853
Q= +2,-1
Q= +2,-2
r F
-
< r Cl
-
Electrostatic (Lattice) Energy
E = k
Q
+
Q
-
r
Q
+
is the charge on the cation
Q
-
is the charge on the anion
r is the distance between the ions
Lattice energy (E) is the energy required to completely separate
one mole of a solid ionic compound into gaseous ions.
9.3
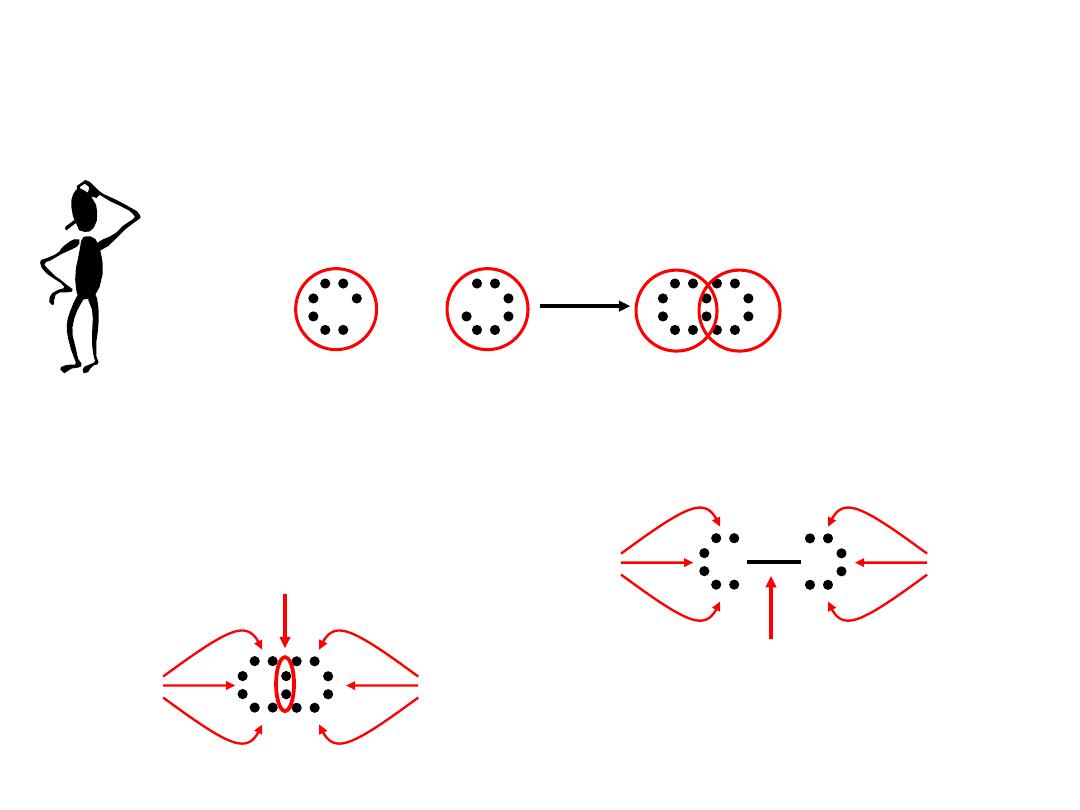
A covalent bond is a chemical bond in which two or more
electrons are shared by two atoms.
Why should two atoms share electrons?
F
F
+
7e
-
7e
-
F F
8e
-
8e
-
F F
F
F
Lewis structure of F
2
lone pairs
lone pairs
lone pairs
lone pairs
single covalent bond
single covalent bond
9.4
8e
-
H
H
O
+
+
O
H
H
O
H
H
or
2e
-
2e
-
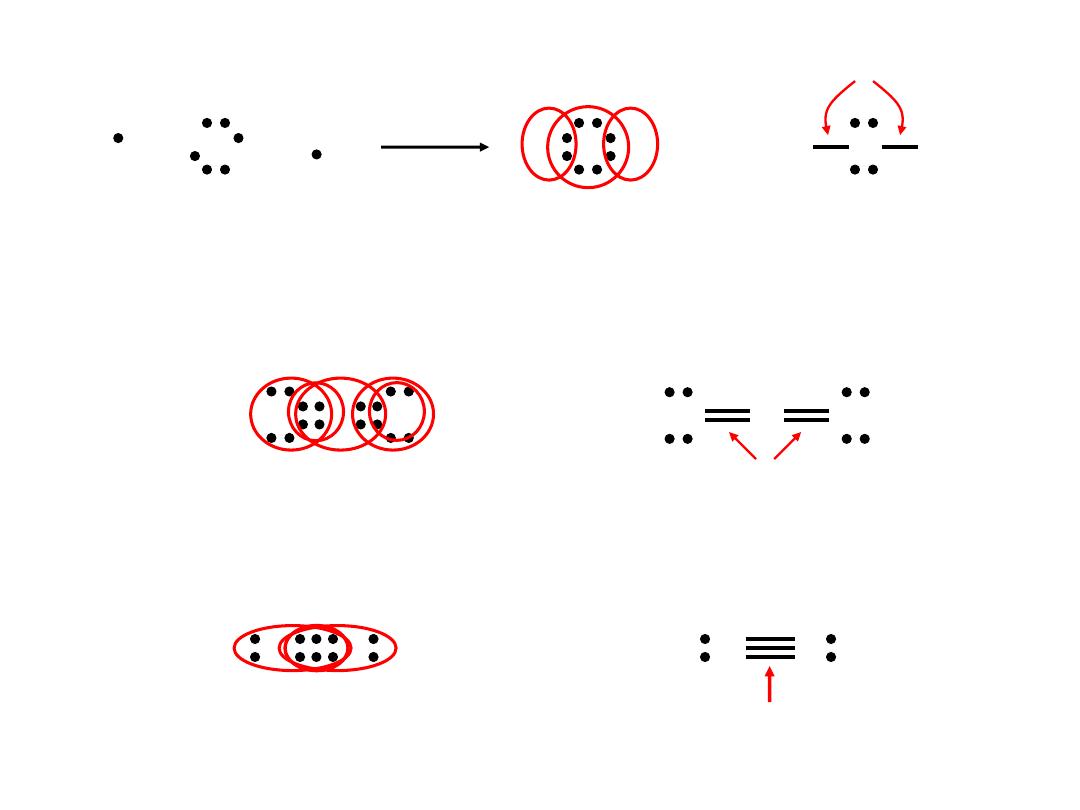
Lewis structure of water
Double bond
– two atoms share two pairs of electrons
single covalent bonds
O C O
or
O
C
O
8e
-
8e
-
8e
-
double bonds
double bonds
Triple bond
– two atoms share three pairs of electrons
N
N
8e
-
8e
-
N
N
triple bond
triple bond
or
9.4
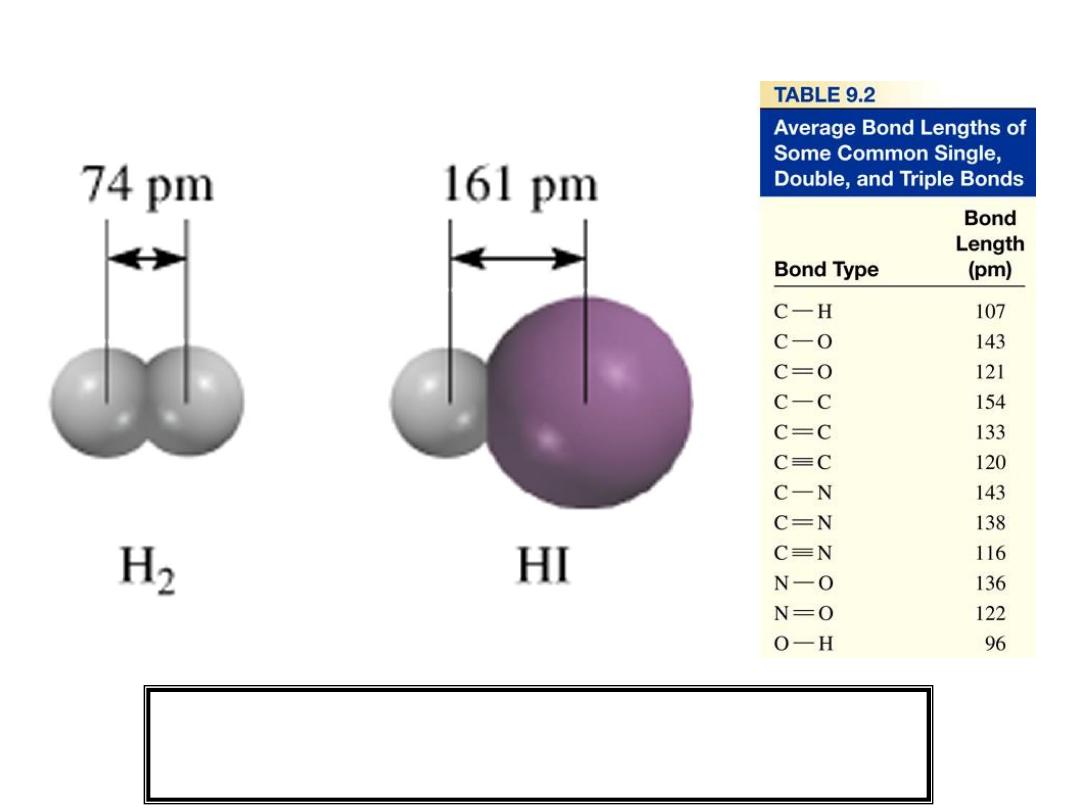
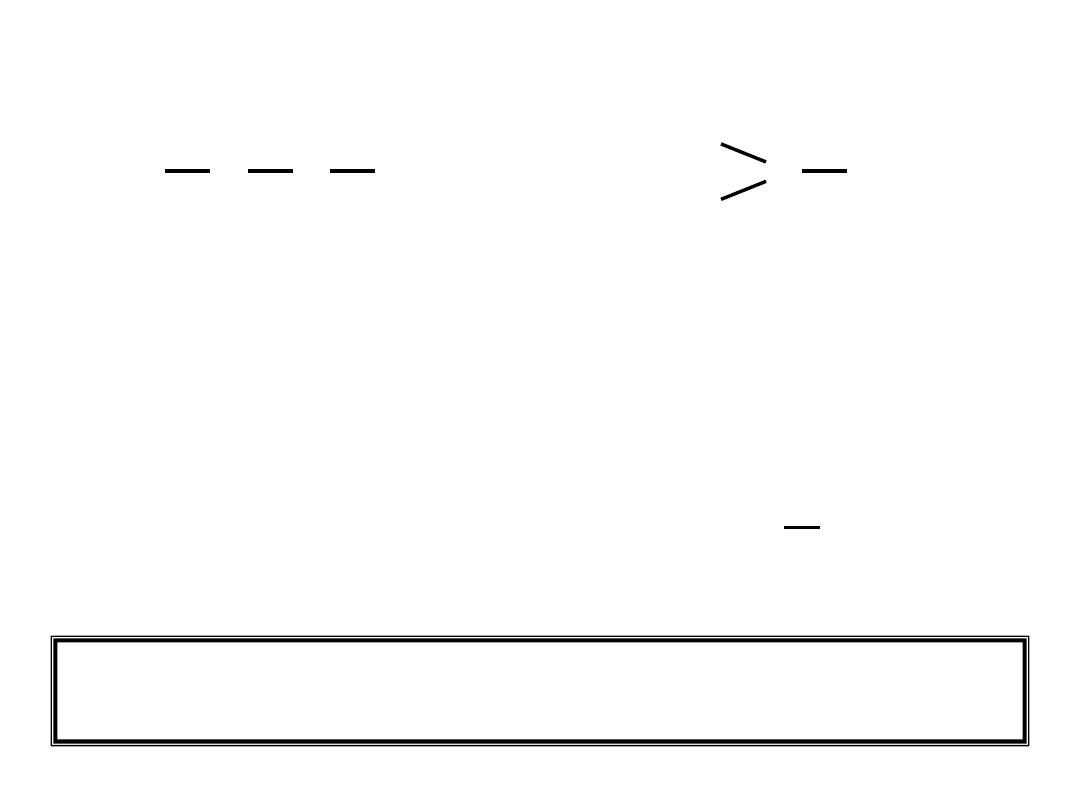
Lengths of Covalent Bonds
Bond Lengths
Triple bond < Double Bond < Single Bond
9.4
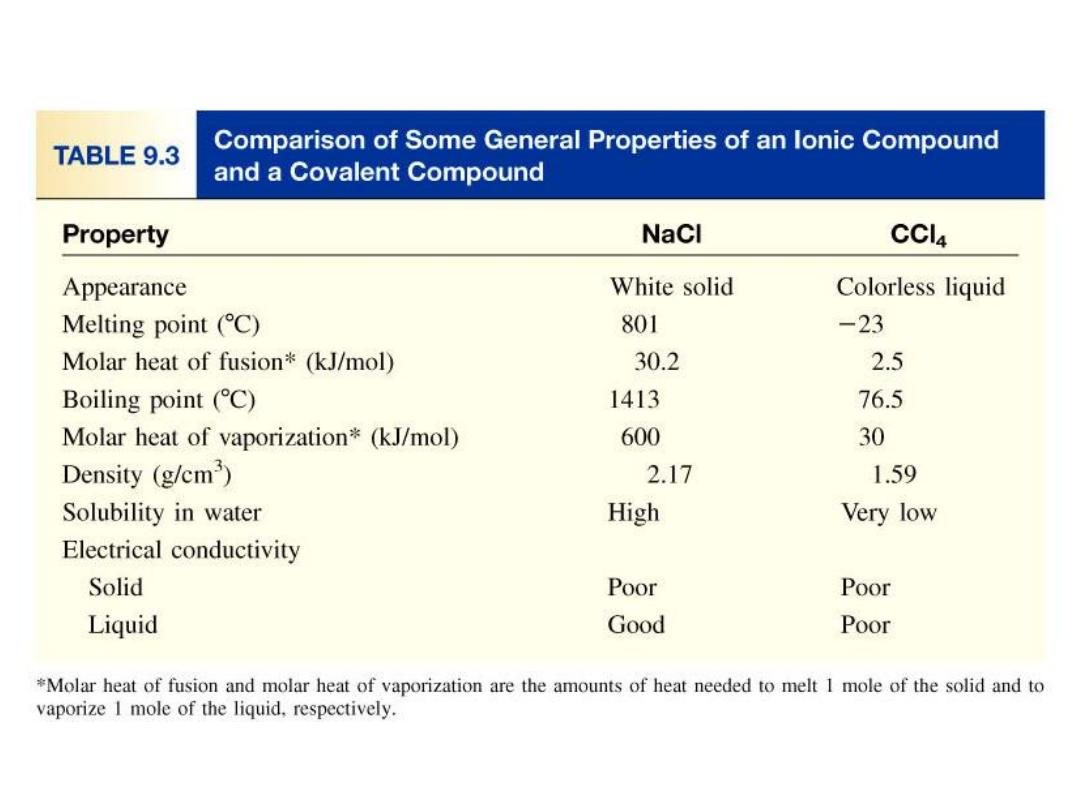
9.4
H
F
F
H
Polar covalent bond or polar bond is a covalent
bond with greater electron density around one of the
two atoms
electron rich
region
electron poor
region
e
-
rich
e
-
poor
d
+
d
-
9.5
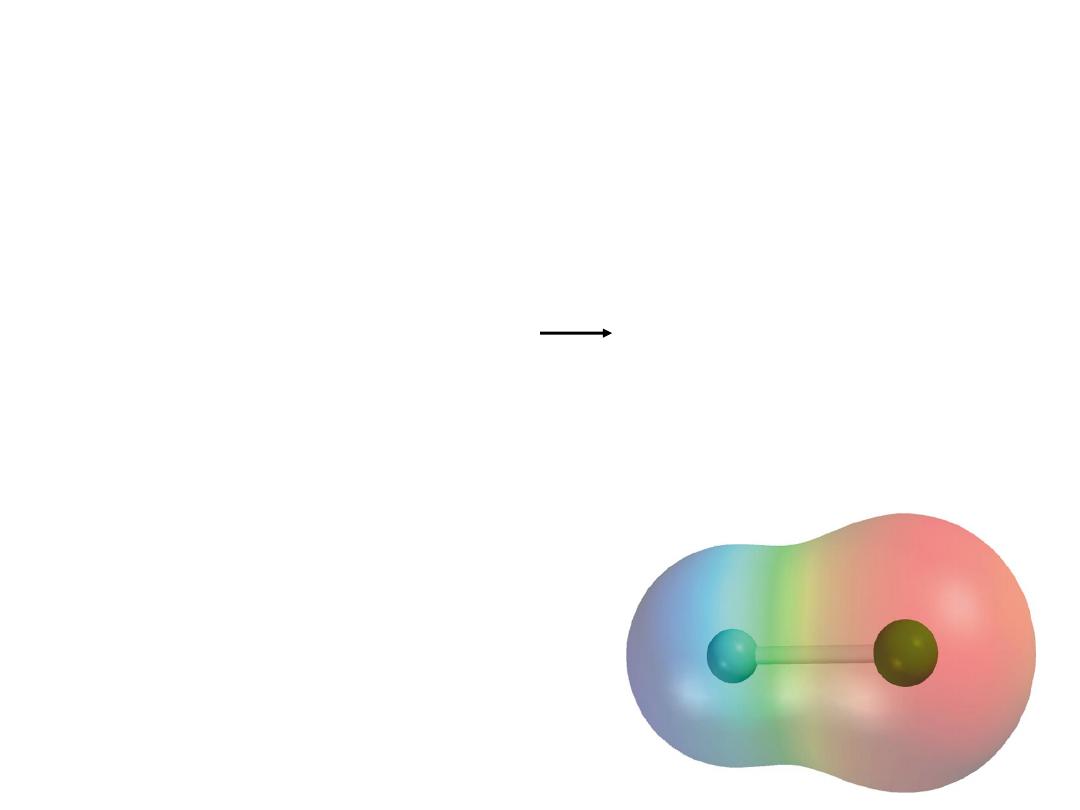
Electronegativity is the ability of an atom to attract
toward itself the electrons in a chemical bond.
Electron Affinity -
measurable
, Cl is highest
Electronegativity -
relative
, F is highest
X
(g)
+ e
-
X
-
(g)
9.5
9.5
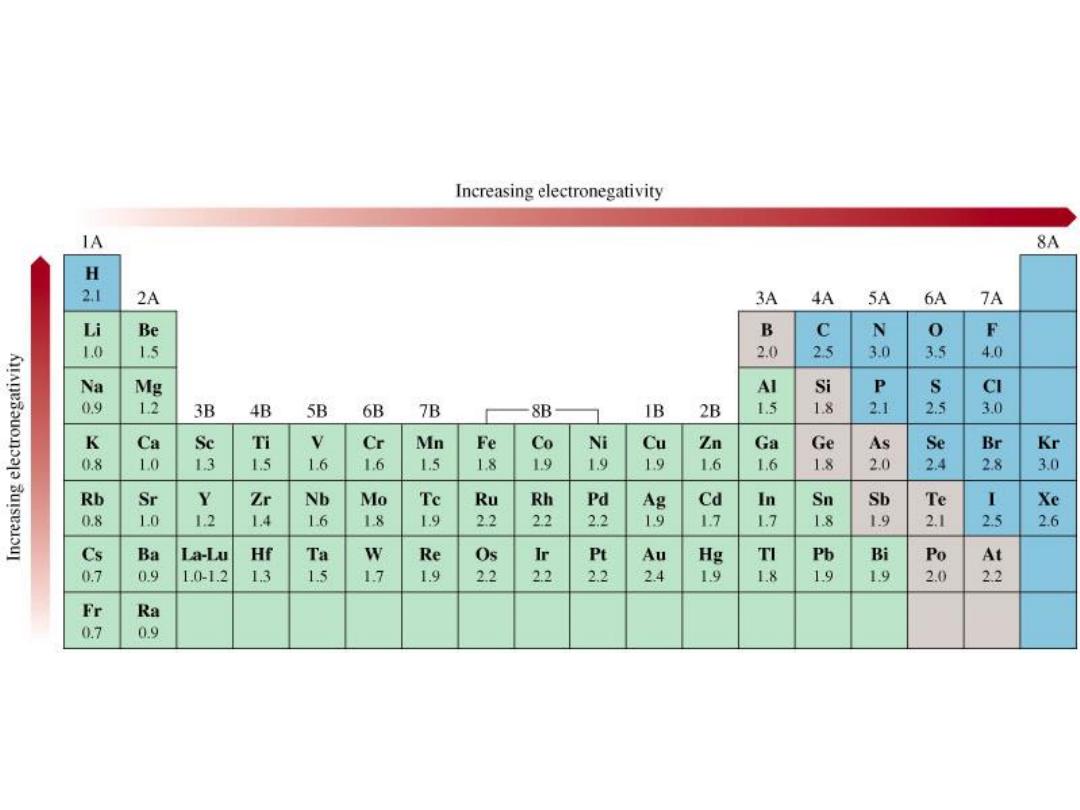
The Electronegativities of Common Elements
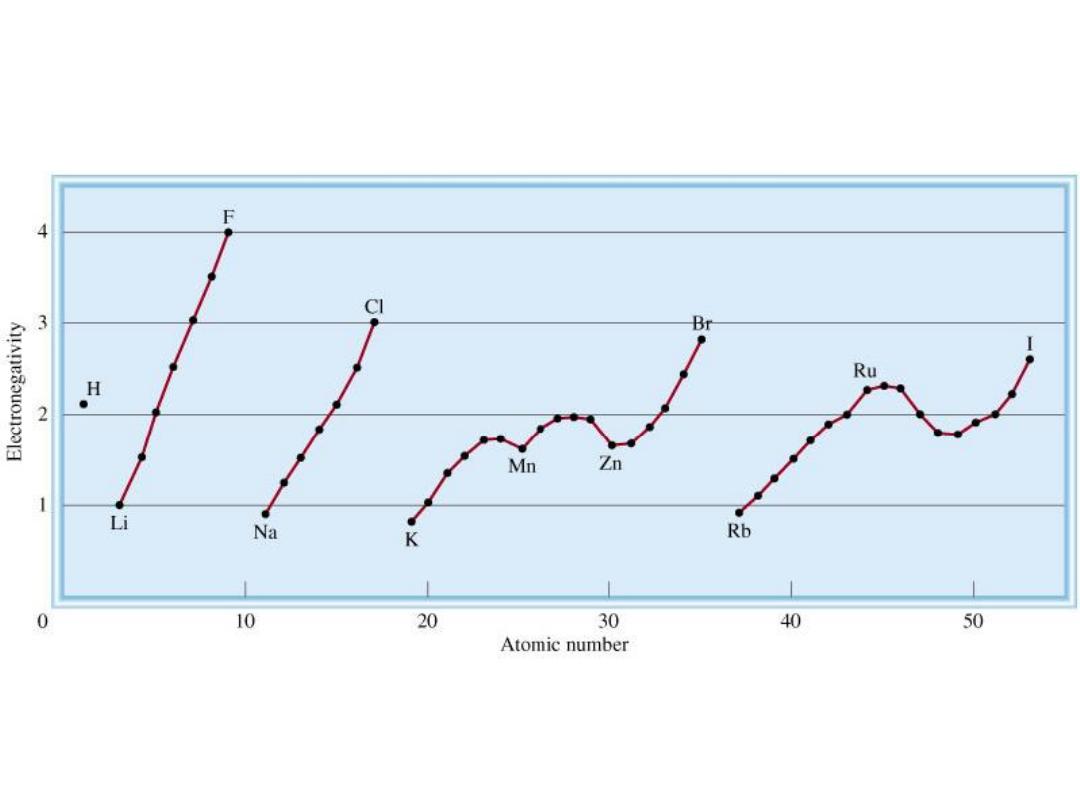
9.5
Variation of Electronegativity with Atomic Number
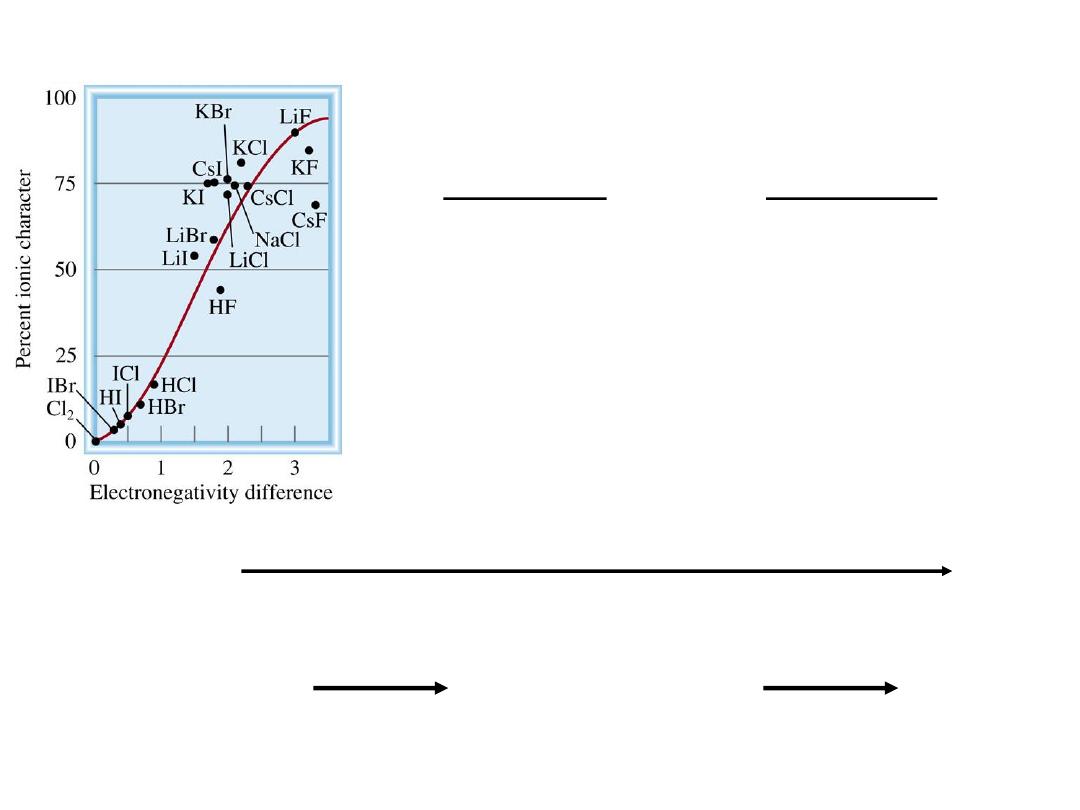
Covalent
share e
-
Polar Covalent
partial transfer of e
-
Ionic
transfer e
-
Increasing difference in electronegativity
Classification of bonds by difference in electronegativity
Difference
Bond Type
0
Covalent
2
Ionic
0 < and <2
Polar Covalent
9.5
Classify the following bonds as ionic, polar covalent,
or covalent: The bond in CsCl; the bond in H
2
S; and
the NN bond in H
2
NNH
2
.
Cs
– 0.7
Cl
– 3.0
3.0
– 0.7 = 2.3
Ionic
H
– 2.1
S
– 2.5
2.5
– 2.1 = 0.4
Polar Covalent
N
– 3.0
N
– 3.0
3.0
– 3.0 = 0
Covalent
9.5

1. Draw skeletal structure of compound showing
what atoms are bonded to each other. Put least
electronegative element in the center.
2. Count total number of valence e
-
. Add 1 for
each negative charge. Subtract 1 for each
positive charge.
3. Complete an octet for all atoms except
hydrogen
4. If structure contains too many electrons, form
double and triple bonds on central atom as
needed.
Writing Lewis Structures
9.6
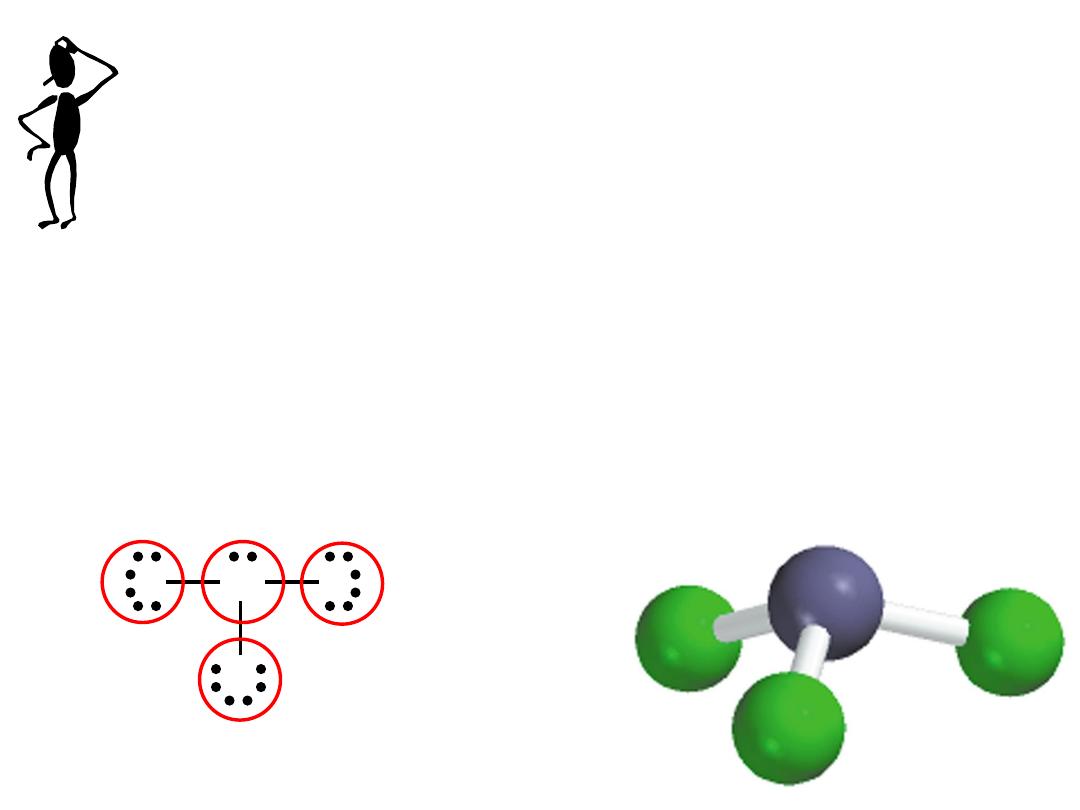
Write the Lewis structure of nitrogen trifluoride (NF
3
).
Step 1
– N is less electronegative than F, put N in center
F
N
F
F
Step 2
– Count valence electrons N - 5 (2s
2
2p
3
) and F - 7 (2s
2
2p
5
)
5 + (3 x 7) =
26 valence electrons
Step 3
– Draw single bonds between N and F atoms and complete
octets on N and F atoms.
Step 4 - Check, are # of e
-
in structure equal to number of valence e
-
?
3 single bonds (3x2) + 10 lone pairs (10x2) =
26 valence electrons
9.6
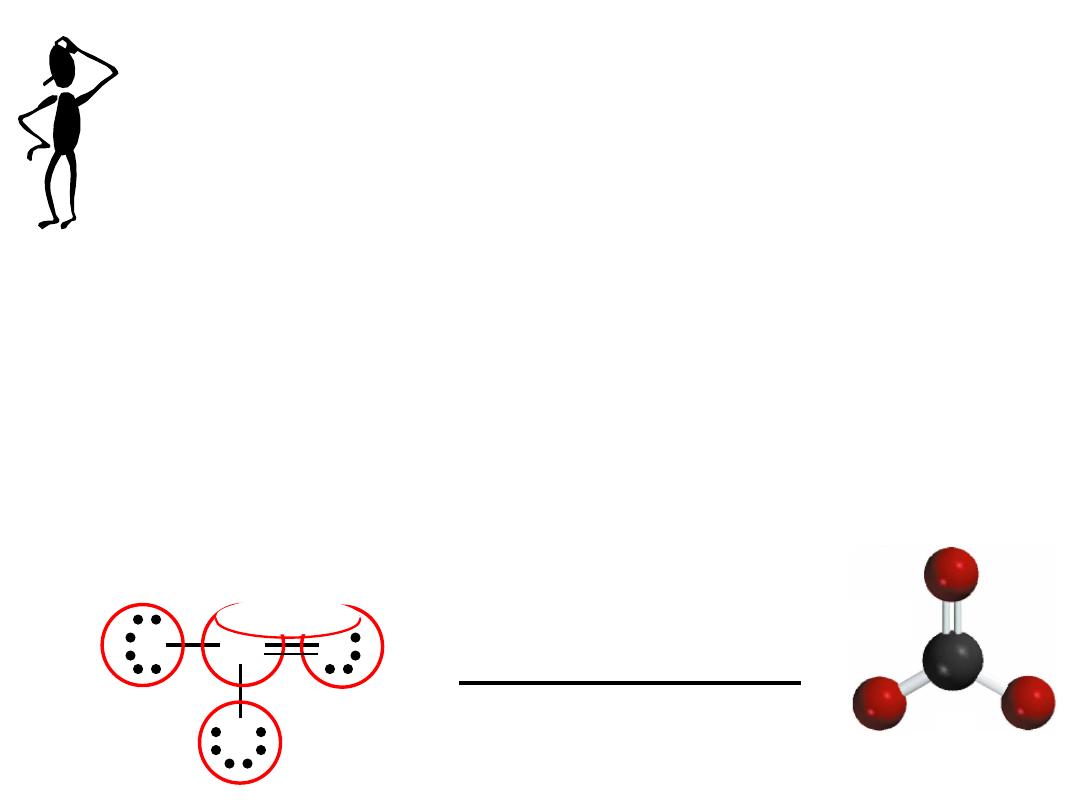
Write the Lewis structure of the carbonate ion (CO
3
2-
).
Step 1
– C is less electronegative than O, put C in center
O
C
O
O
Step 2
– Count valence electrons C - 4 (2s
2
2p
2
) and O - 6 (2s
2
2p
4
)
-2 charge
– 2e
-
4 + (3 x 6) + 2 =
24 valence electrons
Step 3
– Draw single bonds between C and O atoms and complete
octet on C and O atoms.
Step 4 - Check, are # of e
-
in structure equal to number of valence e
-
?
3 single bonds (3x2) + 10 lone pairs (10x2) =
26 valence electrons
9.6
Step 5 - Too many electrons, form double bond and re-check # of e
-
2 single bonds (2x2) = 4
1 double bond = 4
8 lone pairs (8x2) = 16
Total = 24
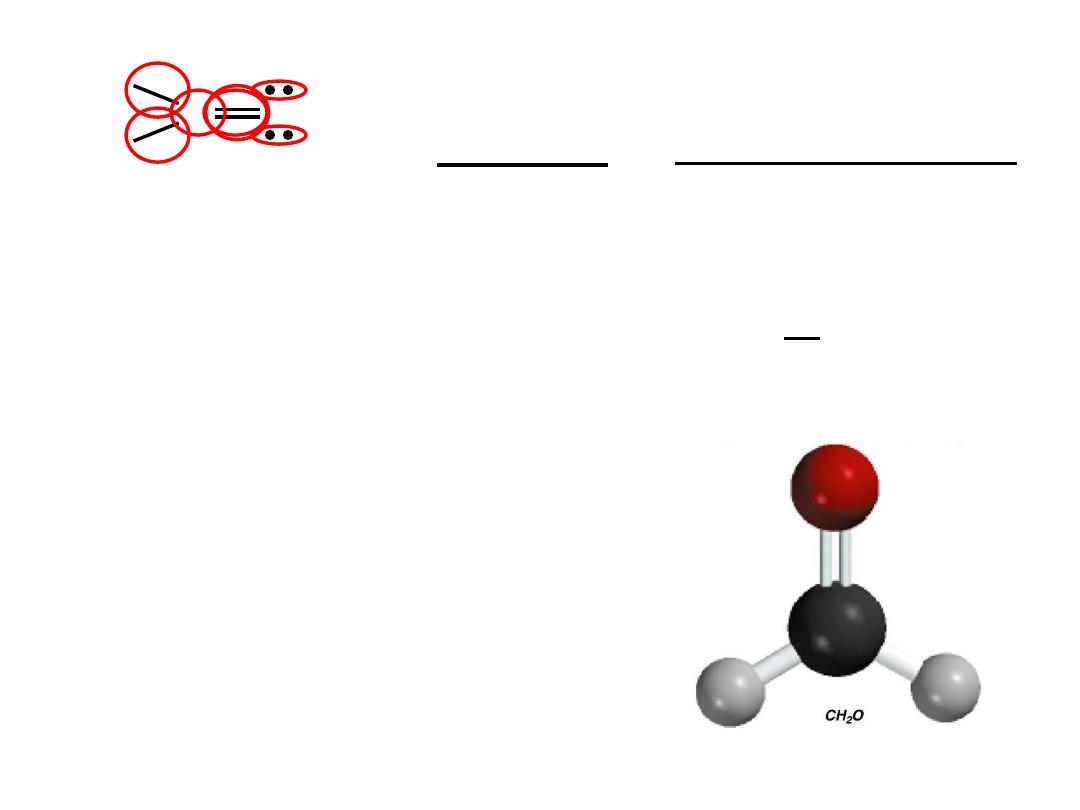
9.7
Two possible skeletal structures of formaldehyde (CH
2
O)
H
C
O
H
H
C
O
H
An atom’s formal charge is the difference between the
number of valence electrons in an isolated atom and the
number of electrons assigned to that atom in a Lewis
structure.
formal charge
on an atom in
a Lewis
structure
=
1
2
total number
of bonding
electrons
(
)
total number
of valence
electrons in
the free atom
-
total number
of nonbonding
electrons
-
The sum of the formal charges of the atoms in a molecule
or ion must equal the charge on the molecule or ion.

H
C
O
H
C
– 4 e
-
O
– 6 e
-
2H
– 2x1 e
-
12 e
-
2 single bonds (2x2) = 4
1 double bond = 4
2 lone pairs (2x2) = 4
Total = 12
formal charge
on C
= 4 -2 -
½ x 6 = -1
formal charge
on O
= 6 -2 -
½ x 6 = +1
formal charge
on an atom in
a Lewis
structure
=
1
2
total number
of bonding
electrons
(
)
total number
of valence
electrons in
the free atom
-
total number
of nonbonding
electrons
-
-1
+1
9.7
C
– 4 e
-
O
– 6 e
-
2H
– 2x1 e
-
12 e
-
2 single bonds (2x2) = 4
1 double bond = 4
2 lone pairs (2x2) = 4
Total = 12
H
C
O
H
formal charge
on C
= 4 - 0 -
½ x 8 = 0
formal charge
on O
= 6 -4 -
½ x 4 = 0
formal charge
on an atom in
a Lewis
structure
=
1
2
total number
of bonding
electrons
(
)
total number
of valence
electrons in
the free atom
-
total number
of nonbonding
electrons
-
0
0
9.7

Formal Charge and Lewis Structures
9.7
1. For neutral molecules, a Lewis structure in which there
are no formal charges is preferable to one in which
formal charges are present.
2. Lewis structures with large formal charges are less
plausible than those with small formal charges.
3. Among Lewis structures having similar distributions of
formal charges, the most plausible structure is the one in
which negative formal charges are placed on the more
electronegative atoms.
Which is the most likely Lewis structure for CH
2
O?
H
C
O
H
-1
+1
H
C
O
H
0
0
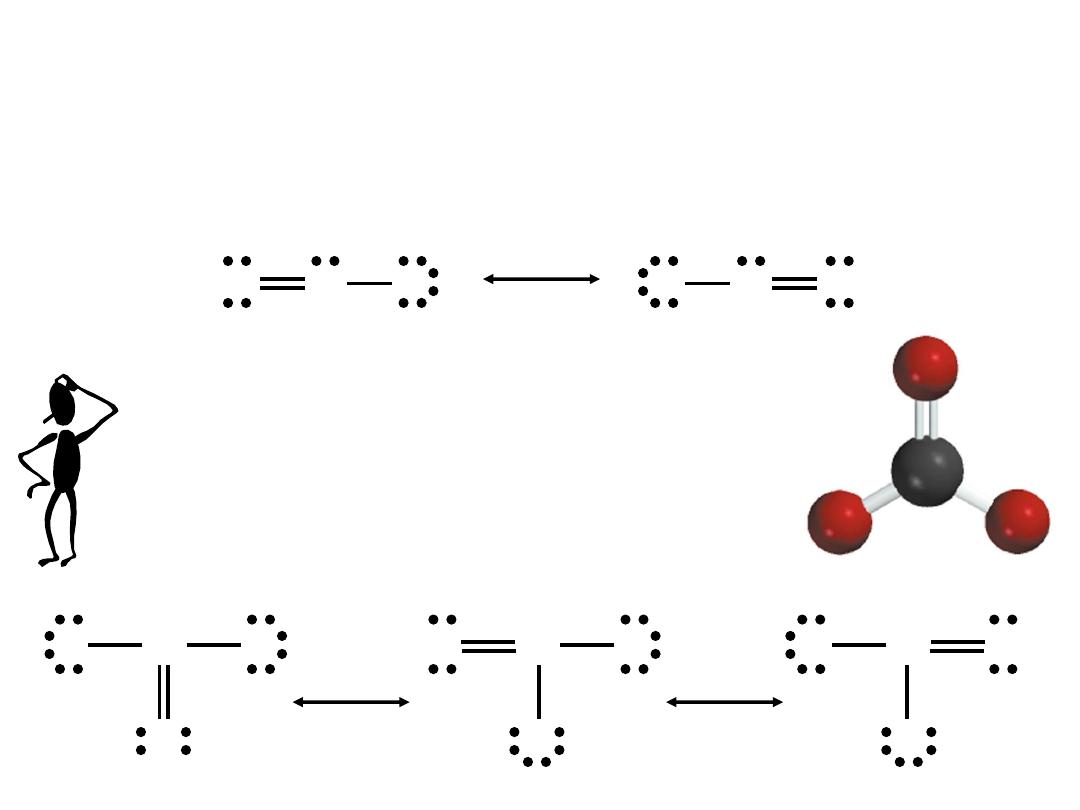
A resonance structure is one of two or more Lewis structures
for a single molecule that cannot be represented accurately by
only one Lewis structure.
O
O
O
+
-
O
O
O
+
-
O
C
O
O
-
-
O
C
O
O
-
-
O
C
O
O
-
-
9.8
What are the resonance structures of the
carbonate (CO
3
2
-) ion?
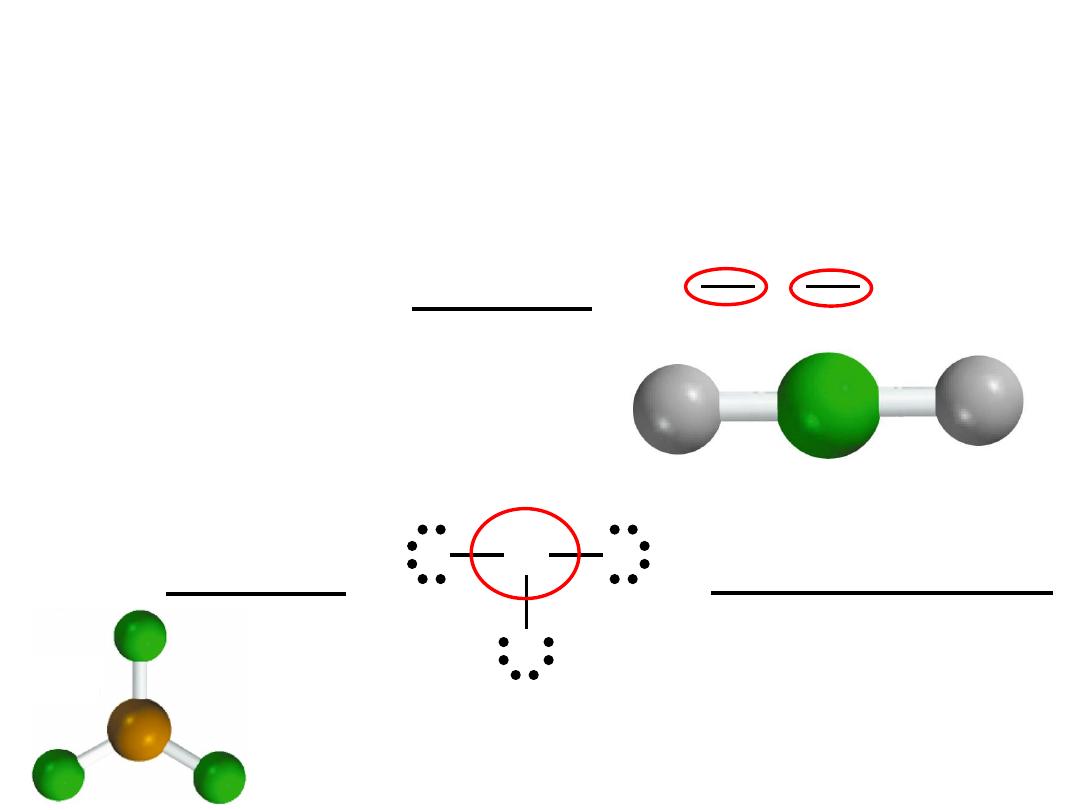
Exceptions to the Octet Rule
The Incomplete Octet
H
H
Be
Be
– 2e
-
2H
– 2x1e
-
4e
-
BeH
2
BF
3
B
– 3e
-
3F
– 3x7e
-
24e
-
F
B
F
F
3 single bonds (3x2) = 6
9 lone pairs (9x2) = 18
Total = 24
9.9
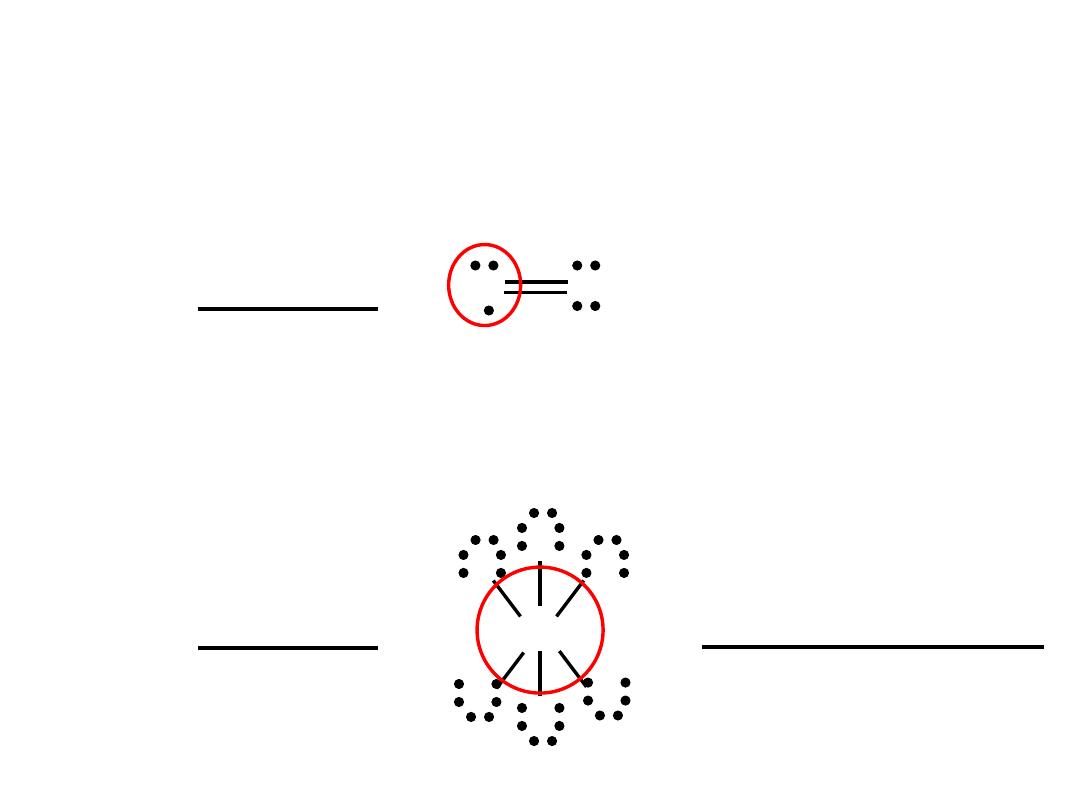
Exceptions to the Octet Rule
Odd-Electron Molecules
N
– 5e
-
O
– 6e
-
11e
-
NO
N
O
The Expanded Octet
(central atom with principal quantum number n > 2)
SF
6
S
– 6e
-
6F
– 42e
-
48e
-
S
F
F
F
F
F
F
6 single bonds (6x2) = 12
18 lone pairs (18x2) = 36
Total = 48
9.9
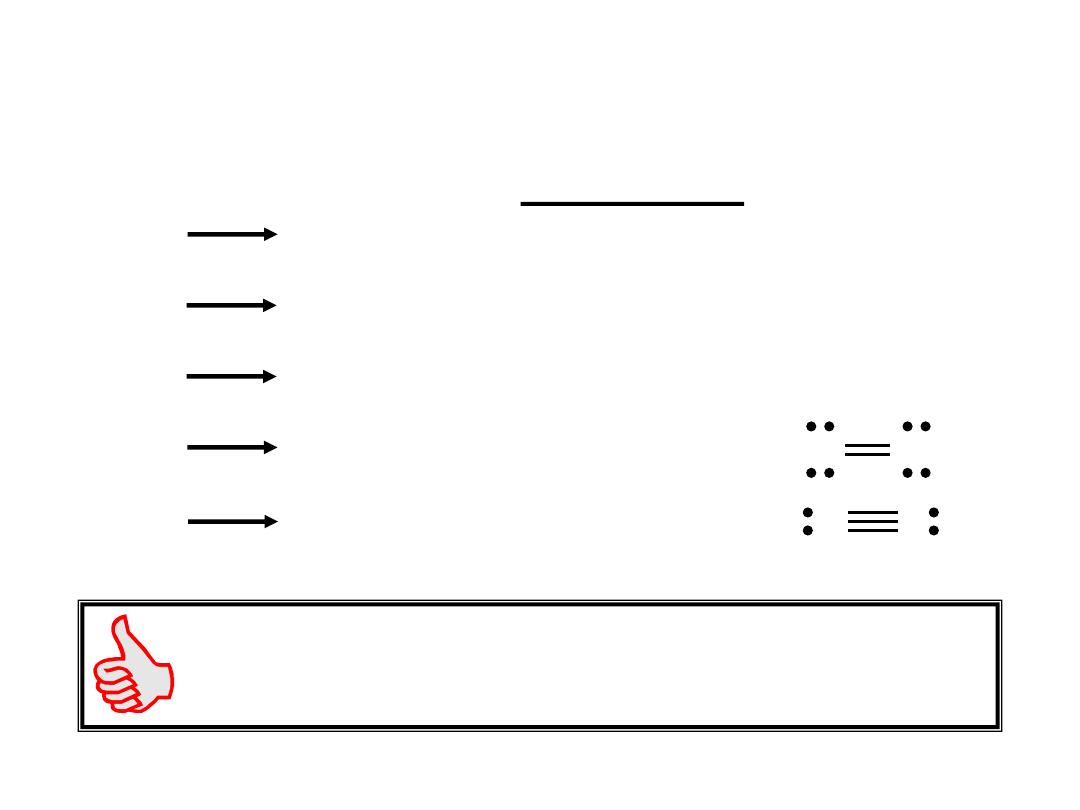
The enthalpy change required to break a particular bond in
one mole of gaseous molecules is the bond energy.
H
2 (g)
H
(g)
+ H
(g)
DH
0
= 436.4 kJ
Cl
2 (g)
Cl
(g)
+ Cl
(g)
DH
0
= 242.7 kJ
HCl
(g)
H
(g)
+ Cl
(g)
DH
0
= 431.9 kJ
O
2 (g)
O
(g)
+ O
(g)
DH
0
= 498.7 kJ
O
O
N
2 (g)
N
(g)
+ N
(g)
DH
0
= 941.4 kJ
N
N
Bond Energy
Bond Energies
Single bond < Double bond < Triple bond
9.10
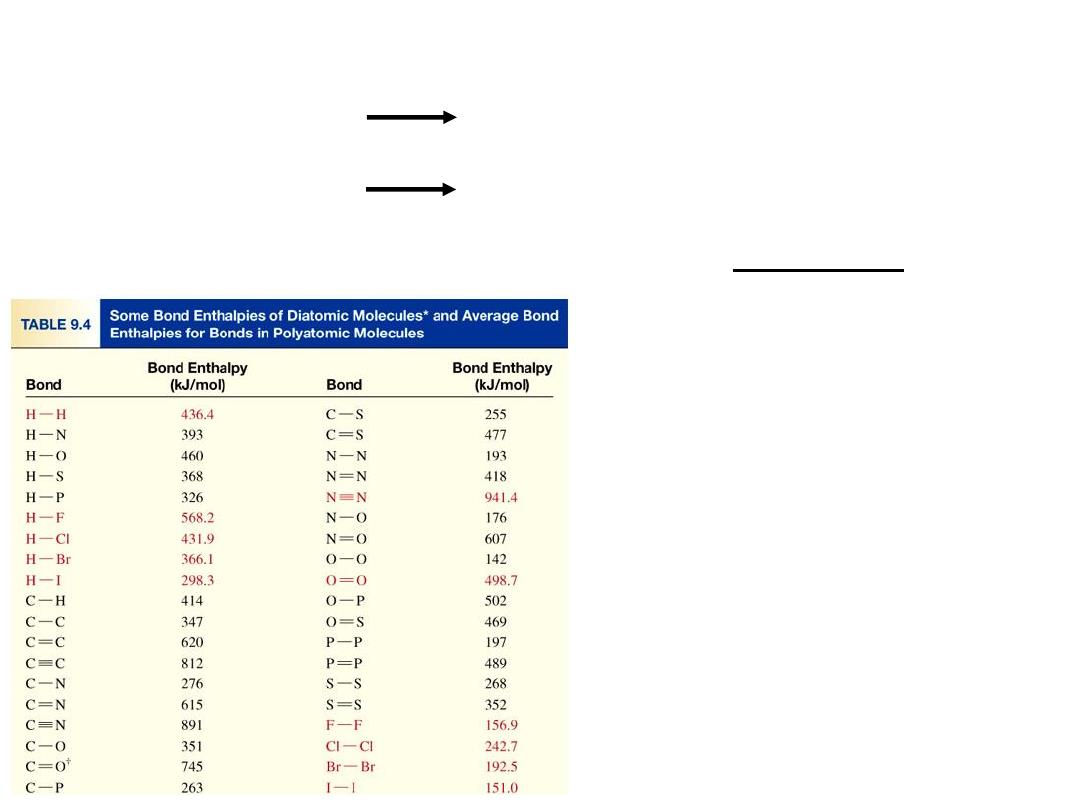
Average bond energy in polyatomic molecules
H
2
O
(g)
H
(g)
+ OH
(g)
DH
0
= 502 kJ
OH
(g)
H
(g)
+ O
(g)
DH
0
= 427 kJ
Average OH bond energy =
502 + 427
2
= 464 kJ
9.10
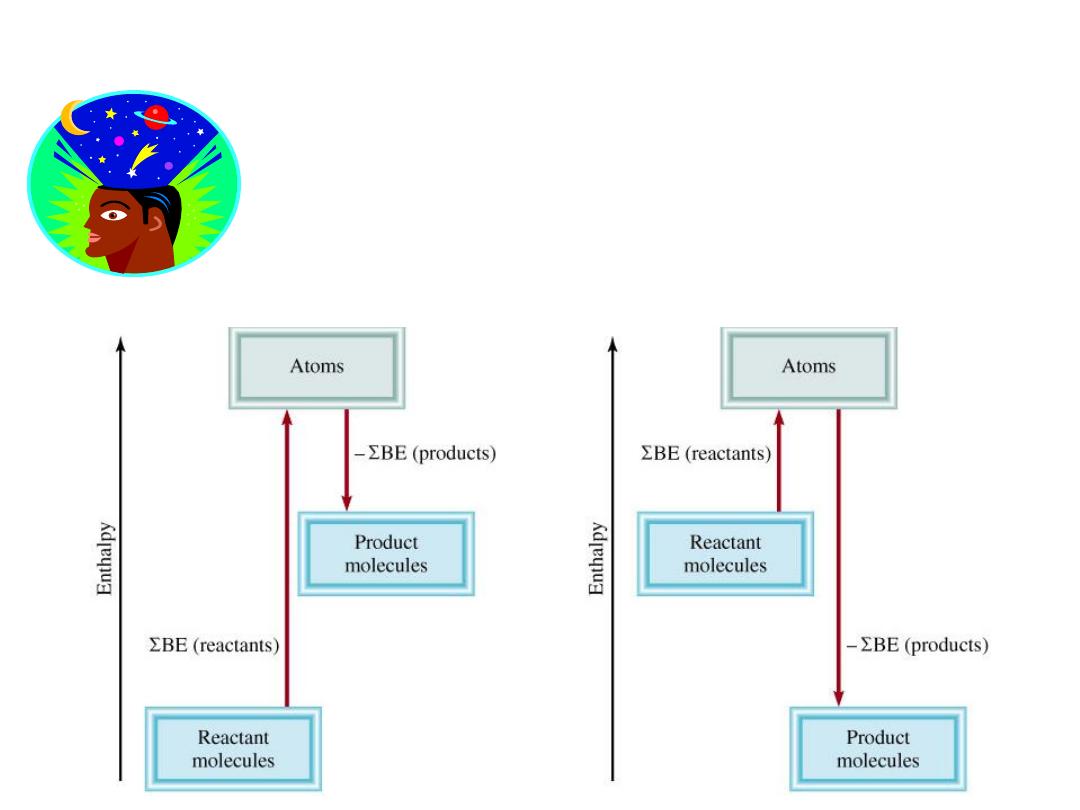
Bond Energies (BE) and Enthalpy changes in reactions
DH
0
= total energy input
– total energy released
=
SBE(reactants) – SBE(products)
Imagine reaction proceeding by breaking all bonds in the
reactants and then using the gaseous atoms to form all the
bonds in the products.
9.10
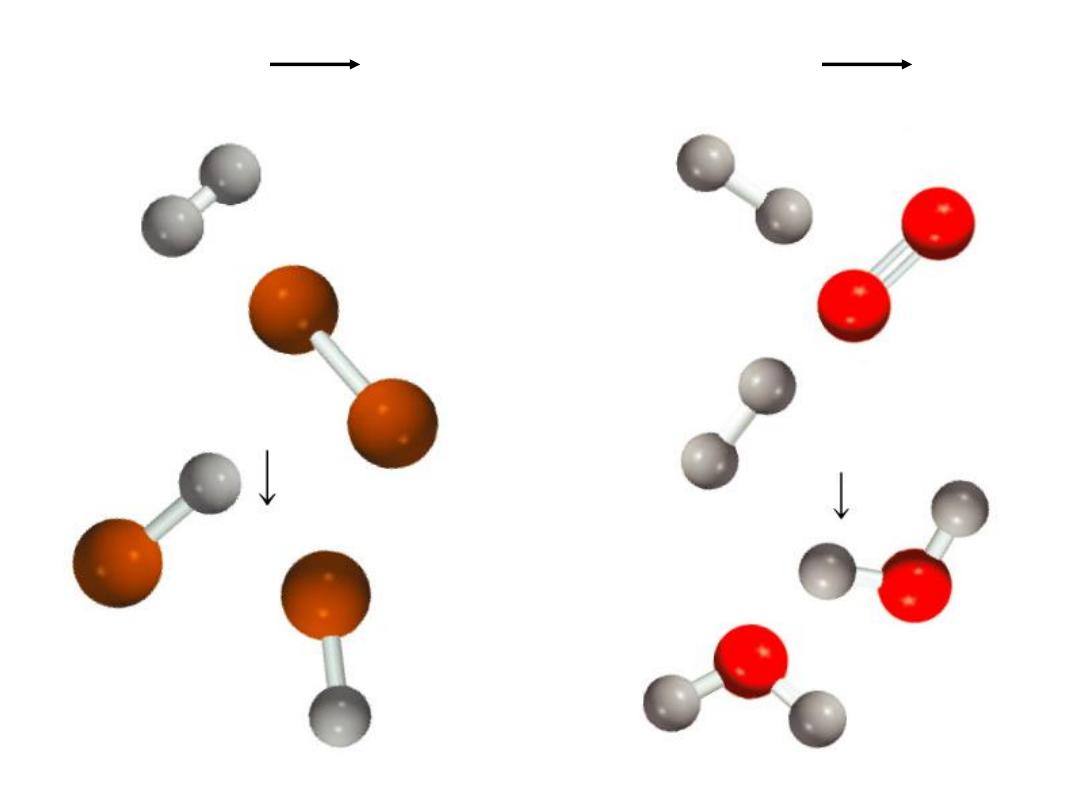
9.10
H
2
(g) + Cl
2
(g) 2HCl (g)
2H
2
(g) + O
2
(g) 2H
2
O (g)

Use bond energies to calculate the enthalpy change for:
H
2 (g)
+ F
2 (g)
2HF
(g)
DH
0
=
SBE(reactants) – SBE(products)
Type of
bonds broken
Number of
bonds broken
Bond energy
(kJ/mol)
Energy
change (kJ)
H
H
1
436.4
436.4
F
F
1
156.9
156.9
Type of
bonds formed
Number of
bonds formed
Bond energy
(kJ/mol)
Energy
change (kJ)
H
F
2
568.2
1136.4
DH
0
= 436.4 + 156.9
– 2 x 568.2 = -543.1 kJ
9.10
