
University of Mosul
College of Pharmacy
Dept. of Pharmaceutical Chemistry
Practical Laboratory
Head of dept. Dr. Nohad Al.Omari
Directed by Ph. Sadeel Shanshal
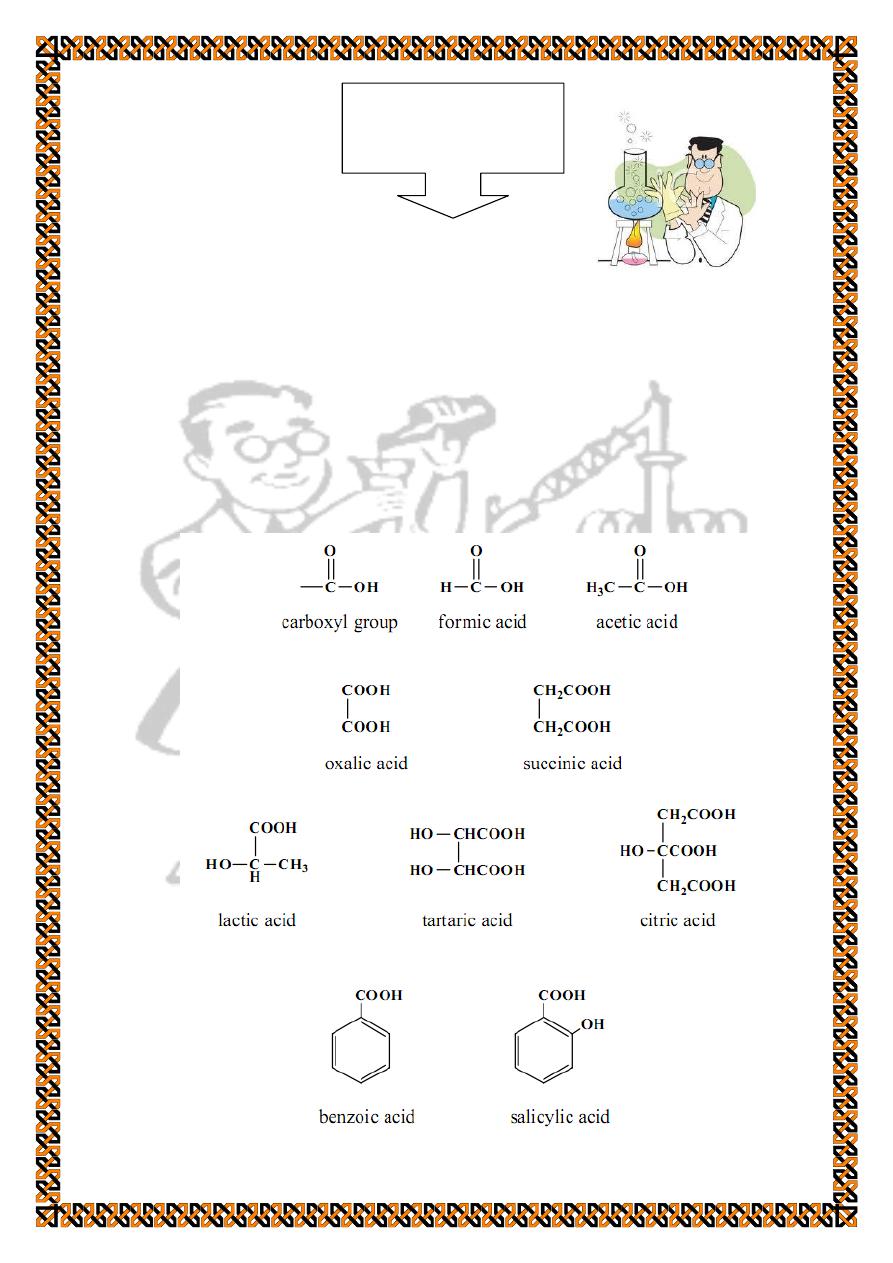
Identification of Carboxylic Acids
Carboxylic acids are organic compounds that have a
carboxyl group attached to an alkyl group (RCOOH) or to an
arylgroup (ArCOOH). The 'R' may be a hydrogen and the result
is formic acid. They may be mono carboxylated , multi
carboxylated , substituted (e. g., hydroxyl groups), or they may
be aromatic.
Experiment
No.1

Physical properties :
Only formic acid, acetic acid, and lactic acid are
liquids at room temperature. The others are solids.
Low molecular weight carboxylic acids are soluble in
water and, therefore, lie under class S
1
. Water
insoluble acids dissolve in both sodium hydroxide
solution and sodium bicarbonate solution, being
classified under class A
1
. When they react with
sodium bicarbonate, they evolve carbon dioxide gas.
This is considered as a good simple indication of
them.
Their boiling points are generally high due to the
association through hydrogen bonds: two molecules of
the carboxylic acid are held together by two hydrogen
bonds rather than one.
Aromatic carboxylic acids burn with a yellow smoky
flame whereas aliphatic ones burn with a blue flame
without smoke.
Chemical properties :
The acidic properties of carboxylic acids are attributed to
the proton of the carboxyl group. Mono carboxylic acids are
weak acids except formic acid, which is the strongest. The
tendency of the alkyl group to release electrons weakens the
acid; thus formic acid is the strongest. On the other hand
presence of electron withdrawing groups (such as halogens)
especially on the alpha carbon increases the acidity.

Reactions of carboxylic acids are related to :
the proton as in salt formation reactions.
removal of the hydroxyl group as in conversion to
derivatives such as esters, amides, or acid chlorides.
substitution either in the alpha position of aliphatic
acids or in the meta position of aromatic ones.
Chemical reactions :
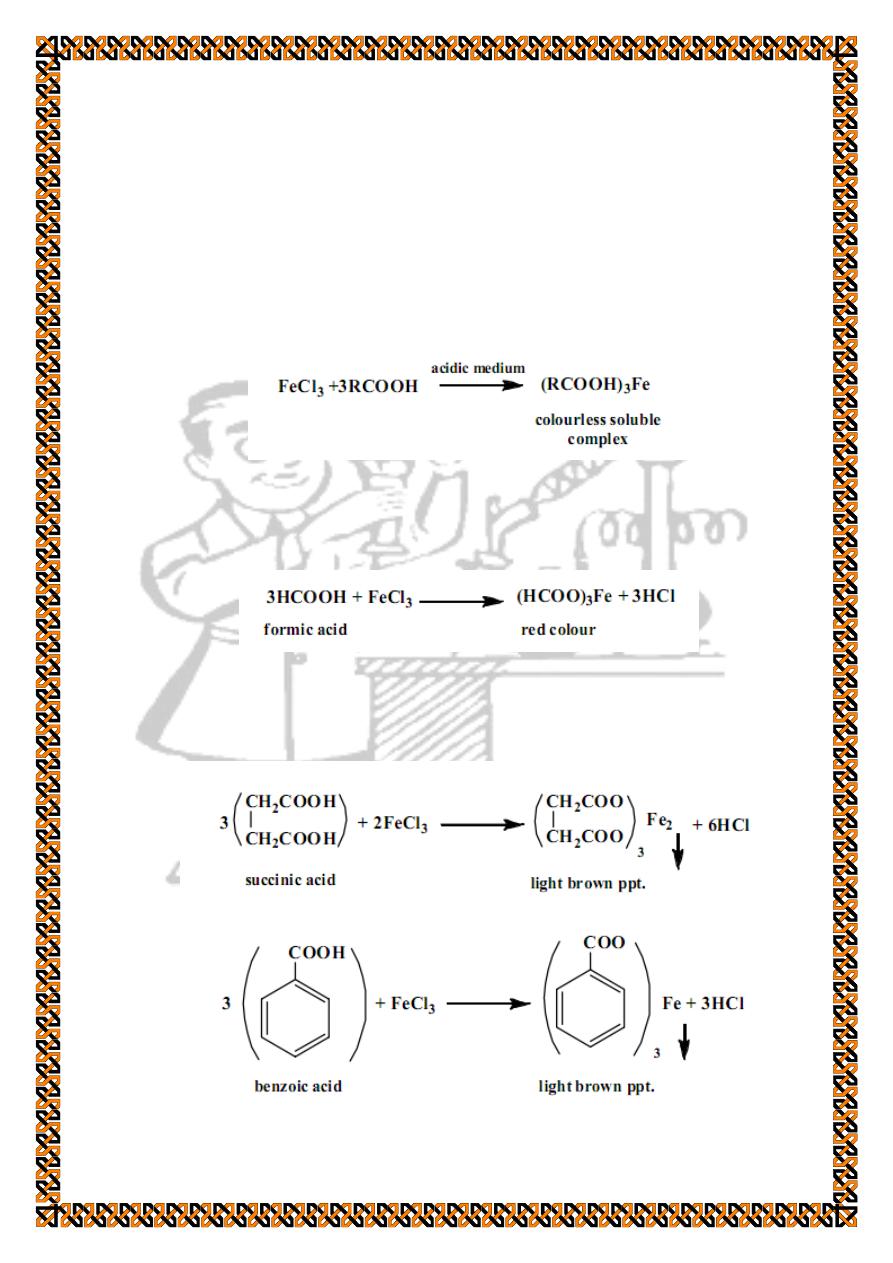
1. General test (Ferric chloride test)
The acid solution should be made neutral before performing
the test with ferric chloride solution. This is achieved by adding
very dilute ammonia solution drop by drop with shaking to a
solution of about 0.5 g of the solid acid or 2 drops of the liquid
acid in 1 ml water until the medium becomes basic as indicated
by changing the colour of litmus paper to blue or changing the
colour of phenolphthalein indicator from colorless to pink, in
which case the characteristic odour of ammonia is predominant.
At this stage the solution is slightly basic. To make the solution
neutral the excess ammonia should be removed by gently
heating the test tube in a water bath with shaking from time to
time until both the odour of ammonia and the pink colour
disappears. (In case of oxalic, tartaric, citric and lactic acids
keep a portion of their neutral solution for use in calcium
chloride test). Cool the solution and then add few drops of ferric
chloride solution to get different colours (solutions or
precipitates) as follows :

Therefore elimination of the excess ammonia is important
since the brown orange precipitate of ferric hydroxide formed
by this excess interferes with the colour of the ferric salt of the
acid resulting in a false result.
If the solution is still acidic (little ammonia is added),
colourless complexes are formed between the acid and ferric
ions, a false negative result.
As mentioned in the above table formic acid and acetic acid
form a red coloured solution in this test :
Succinic acid and benzoic acid give a light brown
precipitate:
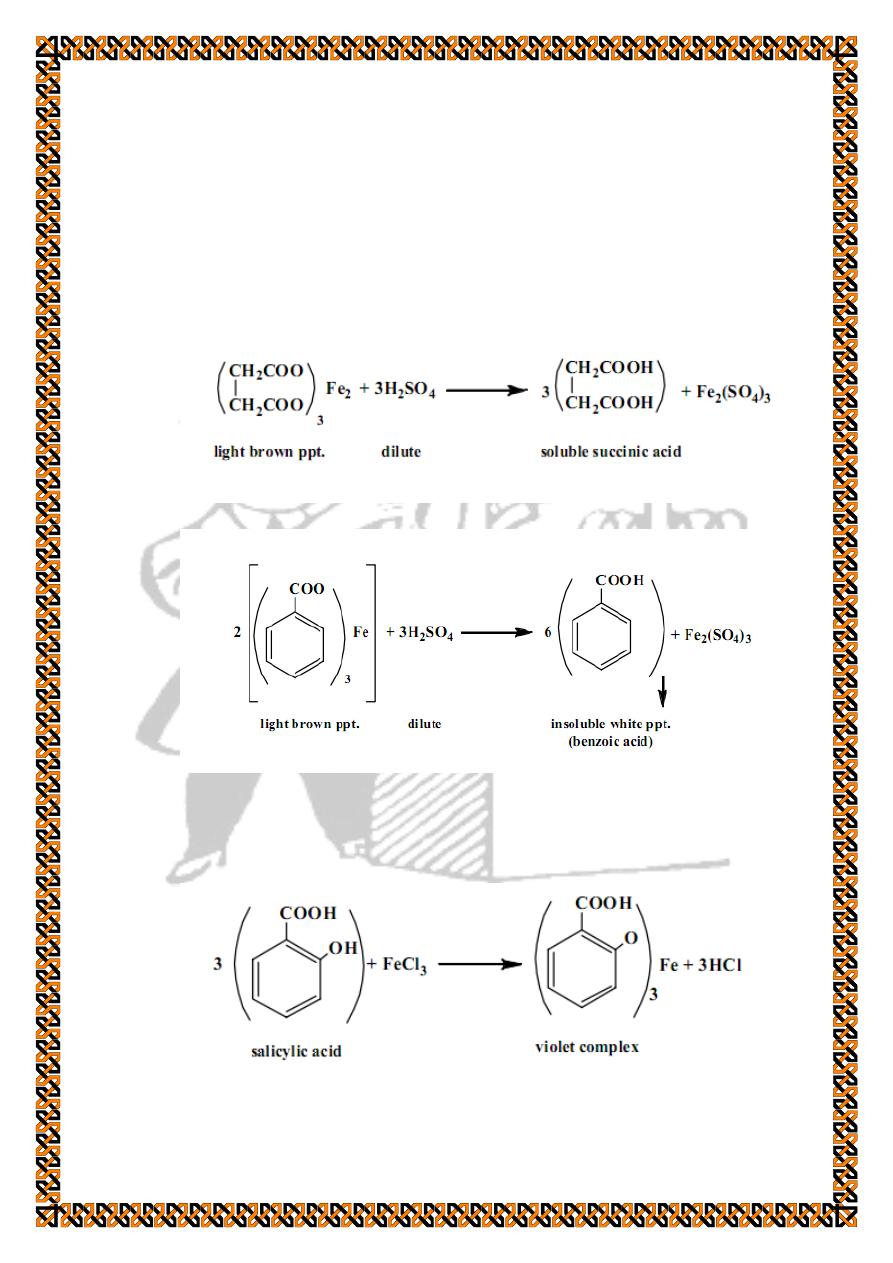
To distinguish between these two acids add few drops of
dilute sulphuric acid to this light brown precipitate with shaking
thereby liberating the free carboxylic acid back. If the liberated
acid is water soluble then it is succinic acid which is aliphatic.
On the other hand benzoic acid is liberated as a white
precipitate because it is insoluble in water since it is aromatic.
Salicylic acid gives a violet colour:
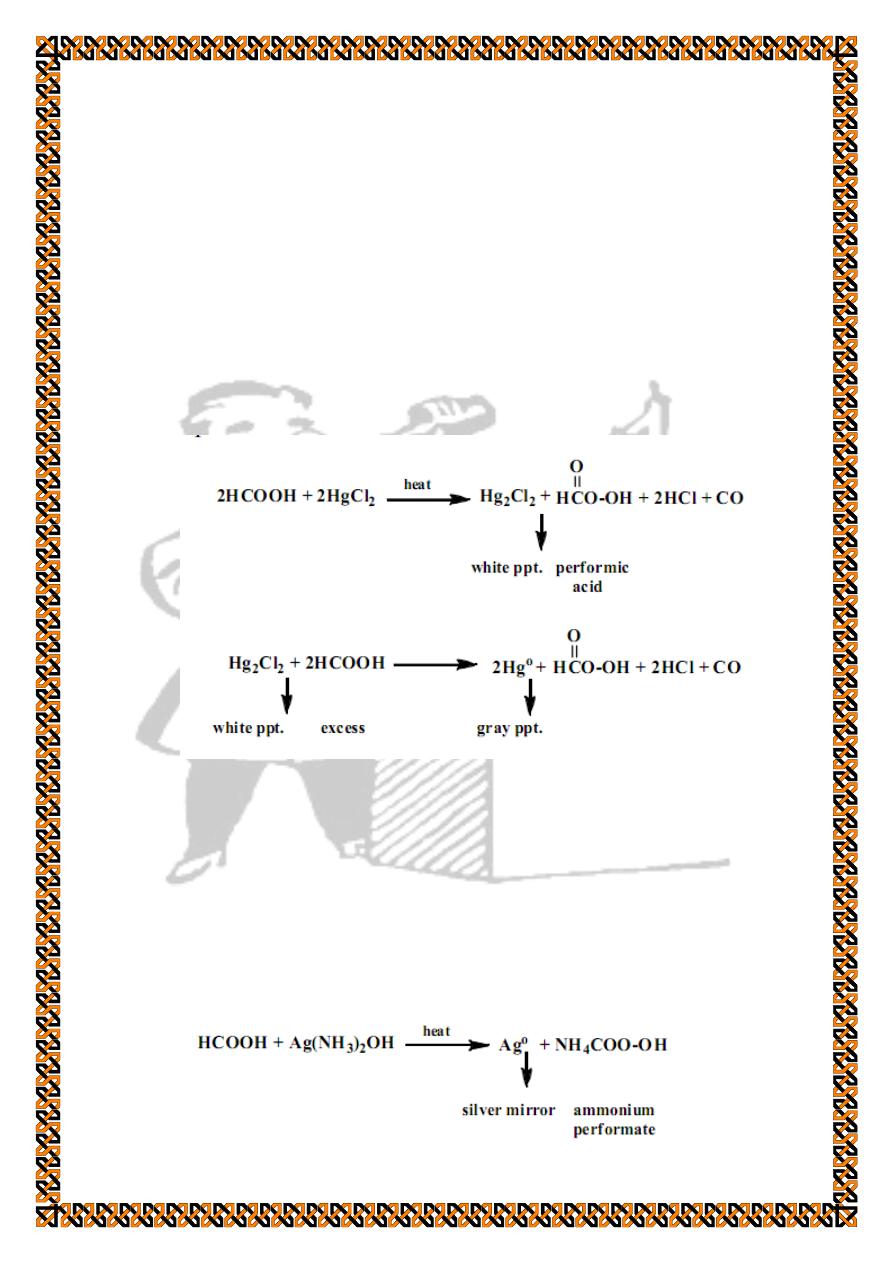
2. Special tests for formic acid
Since formic acid has a hydrogen attached to the carbonyl
group (HC=O) it can reduce certain compounds while being
oxidized :
a) Reduction of mercuric chloride
Formic acid reduces mercuric chloride to mercurous
chloride in the form of white precipitate and, in the presence of
excess acid, mercurous chloride is reduced to mercury element
as a gray precipitate.
To few drops of the acid add few drops of mercuric chloride
solution, and then heat to get a white precipitate. Add excess of
the acid with heating to get the gray precipitate of elemental
mercury.
b) Tollen's test
Refer to the experiment of identification of aldehydes and
ketons for preparation of Tollen's reagent and procedure of this
test.

c) Alkaline potassium permanganate test
Formic acid reacts with potassium permanganate solution, a
strong
oxidizing
agent,
in
alkaline
medium
causing
decolourization of this violet reagent.
Mix 2–3 drops of the acid with 5 ml of sodium bicarbonate
solution, and then add 1 % potassium permanganate solution
drop by drop and observe the disappearance of the original
violet colour of the reagent which will be followed by the
appearance of a brown precipitate of manganese dioxide.
3. Special test for acetic acid (ester formation)
Acetic acid, on contrary to formic acid, neither can be
oxidized by, nor can reduce any of the reagents applied to
formic acid. Instead, it undergoes ester formation reaction :
Mix 1 ml of acetic acid with 2 ml of ethanol in a test tube
and add to this mixture 2–3 drops of concentrated sulphuric
acid. Heat the test tube in a water bath for 10 minutes, and then
pour the mixture into another test tube containing 5 ml sodium
bicarbonate solution; the characteristic fruity odour of ethyl
acetate can be smelt, which indicates the formation of this ester.
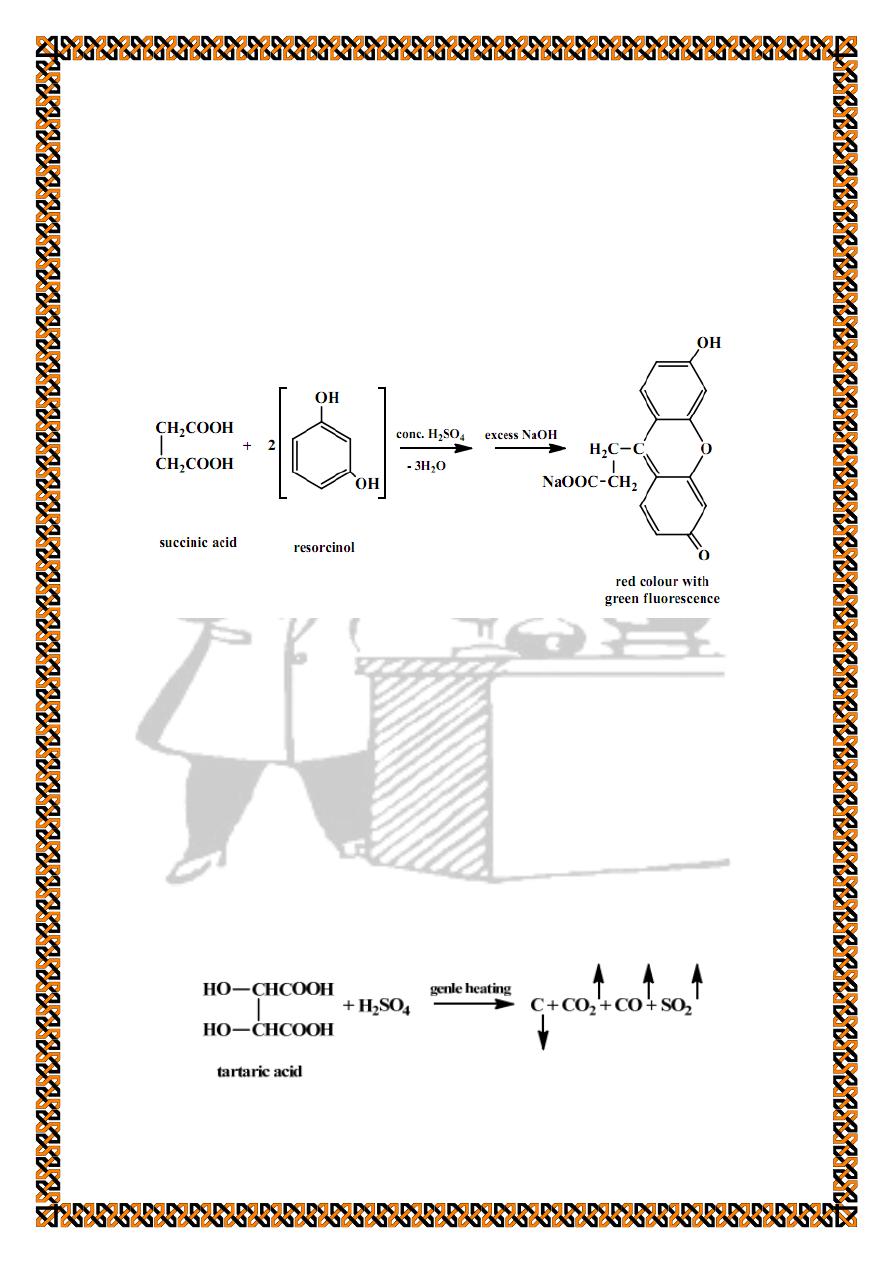
4. Special test for succinic acid (Fluorescence test)
In a dry test tube mix equal quantities of succinic acid and
resorcinol with 2 drops of concentrated sulphuric acid. Heat the
mixture on direct flame for 1 minute until the mixture melts.
Cool and add excess of 10 % sodium hydroxide solution to get a
red colour with green fluorescence. If the colour is not so clear
dilute with water.
5. Special tests for tartaric acid
a) Reaction with concentrated sulphuric acid
When a mixture of about 0.5 g of tartaric acid and 1 ml of
concentrated sulphuric acid is heated gently on a flame with
shaking heavy charring takes place and carbon monoxide,
carbon dioxide, sulphur dioxide gases are evolved.
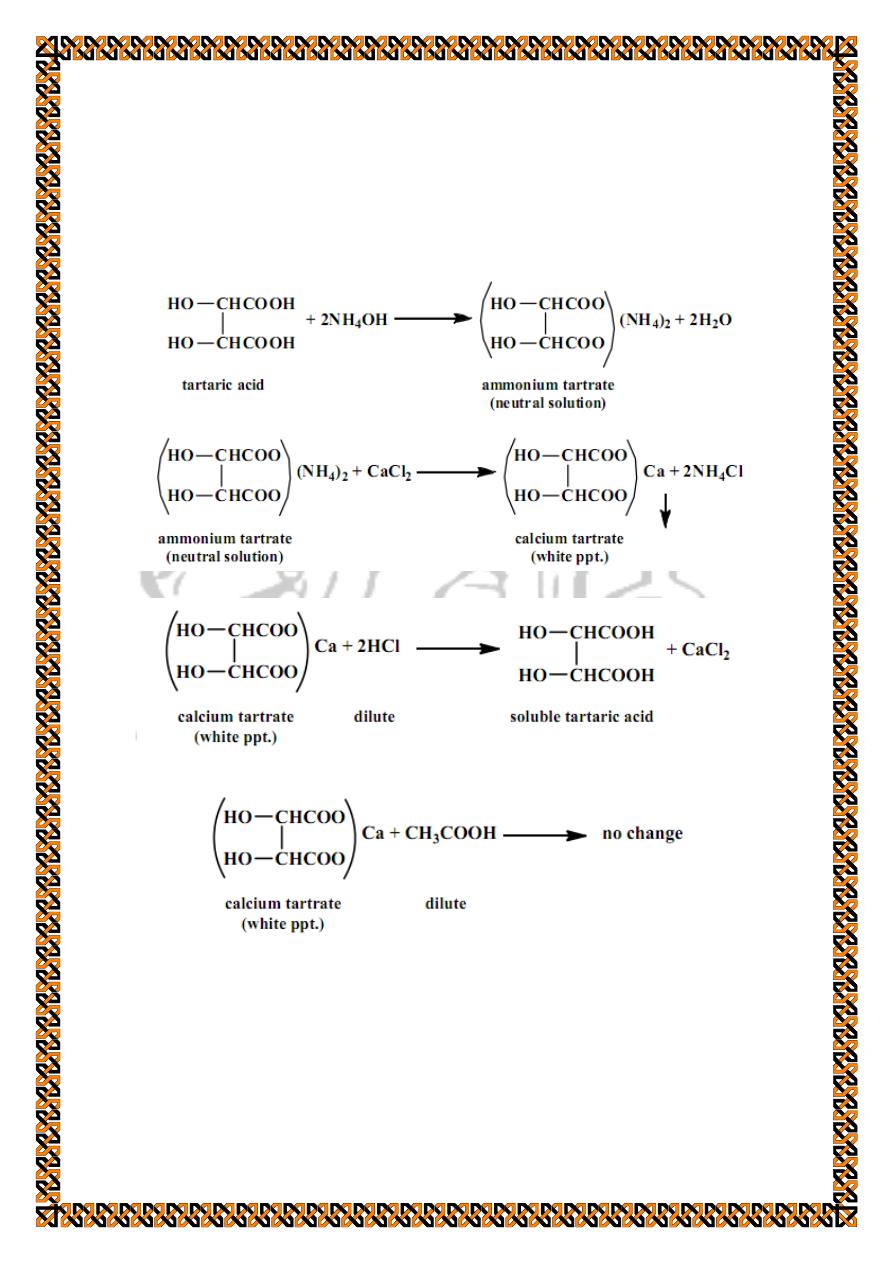
b) Reaction with calcium chloride solution
To about 1 ml of the cold neutral solution of the tartaric
acid (see the general test) add few drops of calcium chloride
solution; a white precipitate of calcium tartrate is formed. This
precipitate dissolves in dilute hydrochloric acid but not in dilute
acetic acid.
c) Reaction with Fenton's reagent
Dissolve about 0.5 g of tartaric acid in 1 ml of water and
then add 1 drop of ferrous sulphate solution followed by 2 drops
of hydrogen peroxide solution. Then add excess of 10 % sodium
hydroxide solution until an intense violet colour is observed.

In this reaction the components of Fenton's reagent
(hydrogen peroxide and iron) undergo an oxidation-reduction
reaction that results in the generation of ferric ions which form
ferric salt of dihydroxyfumaric acid that is responsible for the
violet colour.
6. Special tests for oxalic acid
a) Reaction with potassium permanganate solution
Oxalic acid reacts with acidic potassium permanganate
solution causing decolourization of this reagent. It doesn't react
with this reagent under alkaline medium.
Dissolve 0.5 gm of the acid in 2–3 ml of distilled water and
add 2–3 ml of dilute sulfuric acid. Heat gently (water bath), and
then add potassium permanganate solution drop by drop and
observe the disappearance of the violet color of the reagent.
b) Reaction with calcium chloride solution
For procedure follow the same steps mentioned above for
tartaric acid. The same results are obtained.
c) Reaction with concentrated sulphuric acid
For procedure follow the same steps mentioned above for
tartaric acid. The same gases are bubbled out with a little
darkening.
d) Reaction with Fenton's reagent
For procedure follow the same steps mentioned above for
tartaric acid. Oxalic acid gives negative result with this reagent.
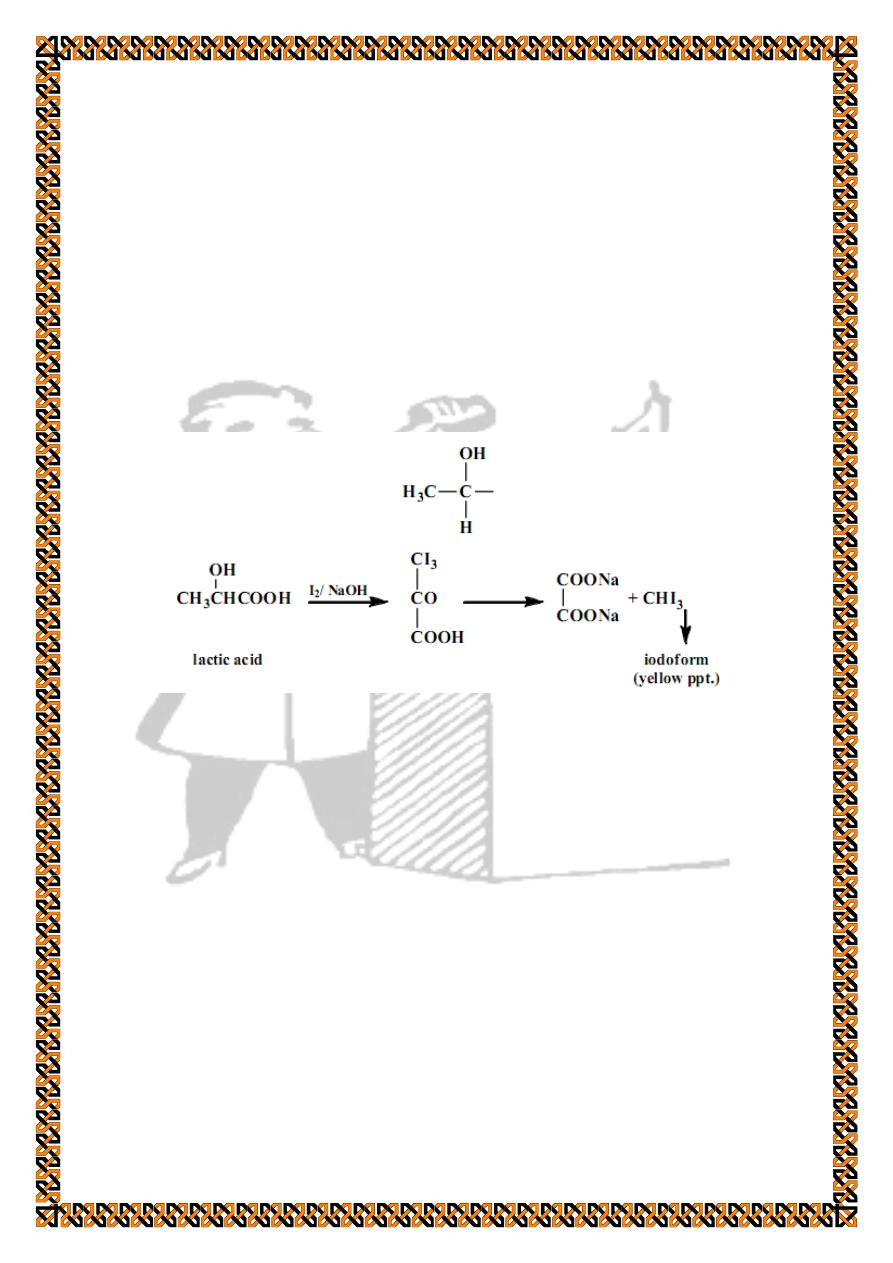
7. Special tests for lactic acid
a) Iodoform test
Lactic acid can undergo iodoform formation reaction since
it contains a free methyl group and a hydrogen attached to the
carbon bearing the hydroxyl group:
For procedure follow the same steps mentioned in the
identification of alcohols experiment.
b) Reaction with concentrated sulphuric acid
For procedure follow the same steps mentioned above for
tartaric acid. The same gases are bubbled out with a
considerable blackening but without a marked charring.
c) Reaction with calcium chloride solution
For procedure follow the same steps mentioned above for
tartaric acid. Lactic acid gives negative result.
d) Reaction with Fenton's reagent
For procedure follow the same steps mentioned above for
tartaric acid. Lactic acid gives negative result with this reagent.
8. Special tests for citric acid
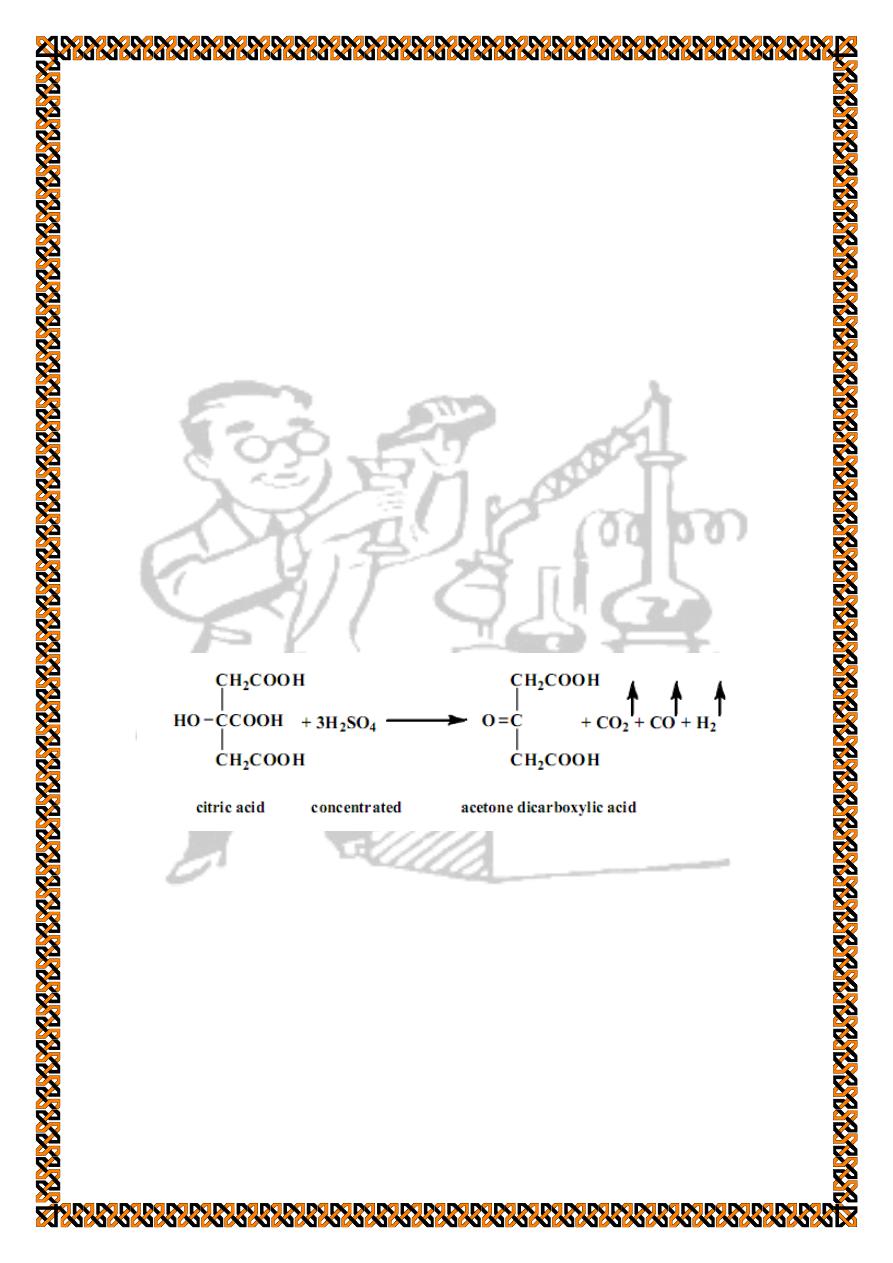
a) Reaction with concentrated sulphuric acid
For procedure follow the same steps mentioned above for
tartaric acid.
The same gases are bubbled out and the mixture turns to
yellow but does not char. Acetone dicarboxylic acid is also
formed, and its presence is tested by heating the mixture for 1
minute , cool , add a few mls of water and make alkaline with
30% sodium hydroxide solution. Add a few mls of sodium
nitroprusside solution and observe the intense red colouration of
the medium.
b) Reaction with calcium chloride solution
For procedure follow the same steps mentioned above for
tartaric acid. Citric acid gives the same results.
c) Reaction with Fenton's reagent
For procedure follow the same steps mentioned above for
tartaric acid. Citric acid gives negative result with this reagent.

9. Special test for salicylic acid (ester formation)
In addition to the characteristic violet colour obtained with
ferric chloride, salicylic acid can also be detected by ester
formation test. In this test methyl salicylate ester separates out
as an organic phase having a characteristic odour.
Follow the same procedure and conditions used for
esterification of acetic acid but use methanol instead of ethanol.
Note that methanol is toxic internally so never withdraw it
by mouth to avoid accidental ingestion.

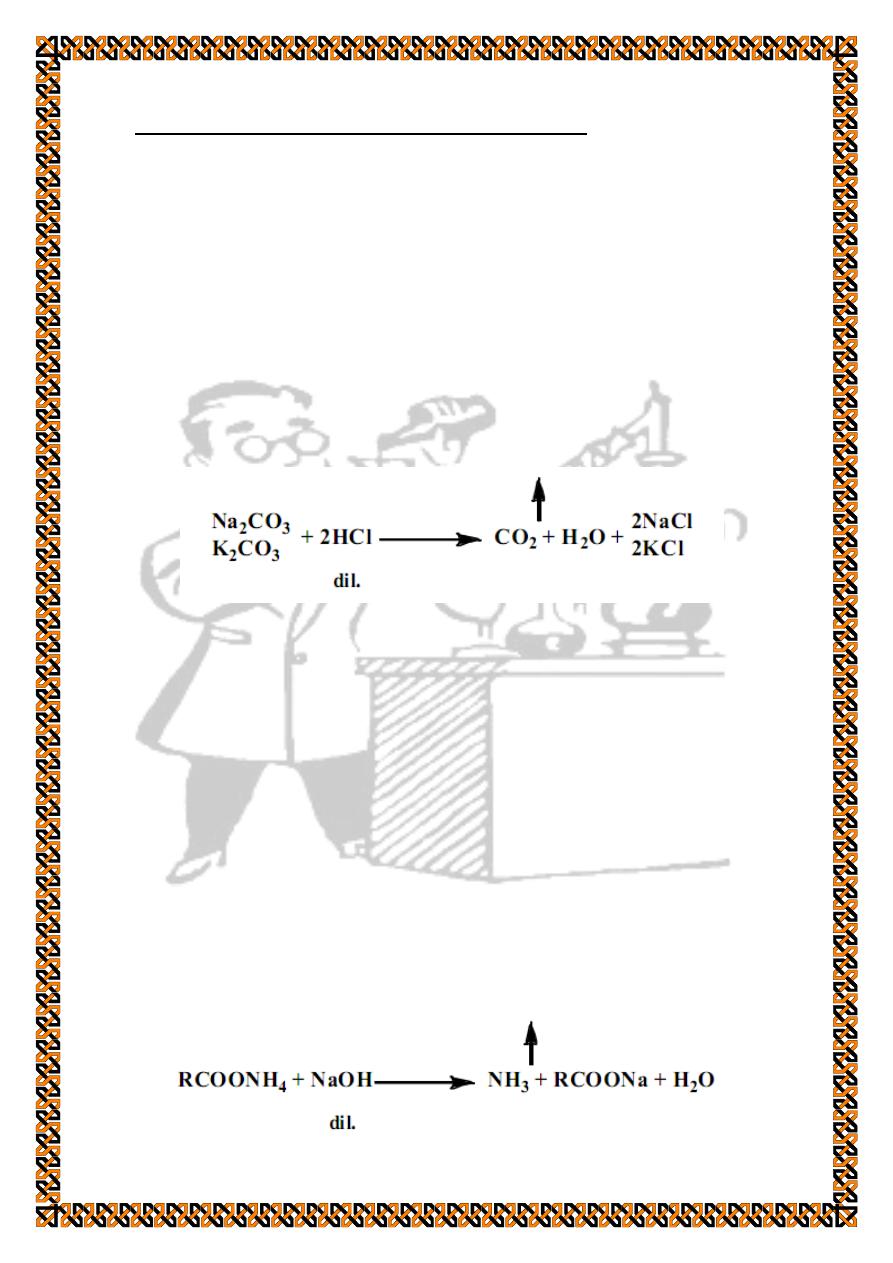
Identification of Carboxylic Acids Salts
Carboxylic acids salts are organic compounds with the
general formula (RCOOM) where (RCOO-) refers to the
carboxylic acid part and (M+) is the alkali part which, in this
experiment, may be either a metal cation (Na+ or K+) or
ammonium (NH4+). These salts are colourless or white
crystalline solids and are soluble in cold or hot water.
Identification of the carboxylic acid part (anionic part)
The carboxylic acid part can be identified by the usual steps
for identification of carboxylic acids starting with ferric chloride
test and, according to the result observed, the proper special test
should be performed then to conclude the carboxylate name
(formate, lactate, salicylate, etc.).
Experiment
No.2
Identification of the alkali part (cationic part)
Identification of sodium or potassium cations
Place about 0.1 g of the salt on the edge of a metal spatula
and start heating it gently on a flame with gradual increase in the
heat strength.
Sodium and potassium salts leave a residual amount of solid
on the spatula in addition to the carbon coming from
decomposition of the organic part. This residual solid may be
sodium carbonate or potassium carbonate and can be detected,
after cooling, by the addition of few drops of dilute hydrochloric
acid solution which results in a strong effervescence within the
residual solid due to liberation of carbon dioxide gas :
During ignition observe the colour of the flame. Sodium
salts burn with a golden yellow flame whereas potassium salts
burn with a purple flame.
Identification of ammonium cation
Repeat the ignition procedure mentioned above and note
that ammonium salts don't leave any residual solid except the
carbon coming from decomposition of the organic part. After
cooling, addition of few drops of dilute hydrochloric acid does
not result in any effervescence.
Ammonium cation can be detected as follows. Place few
crystals of the salt in a test tube and add 0.5 ml of 10 % sodium
hydroxide solution. At this stage free ammonia is liberated and
can be smelt easily:

Place a small filter paper over the top of the tube and fold it
down around the tube. Add 2 drops of 10 % copper sulphate
solution on the filter paper covering the mouth of the test tube.
Heat the test tube mildly on a flame to boil the mixture. The
liberated ammonia will react with the copper ions present on the
filter paper resulting in a blue colour.
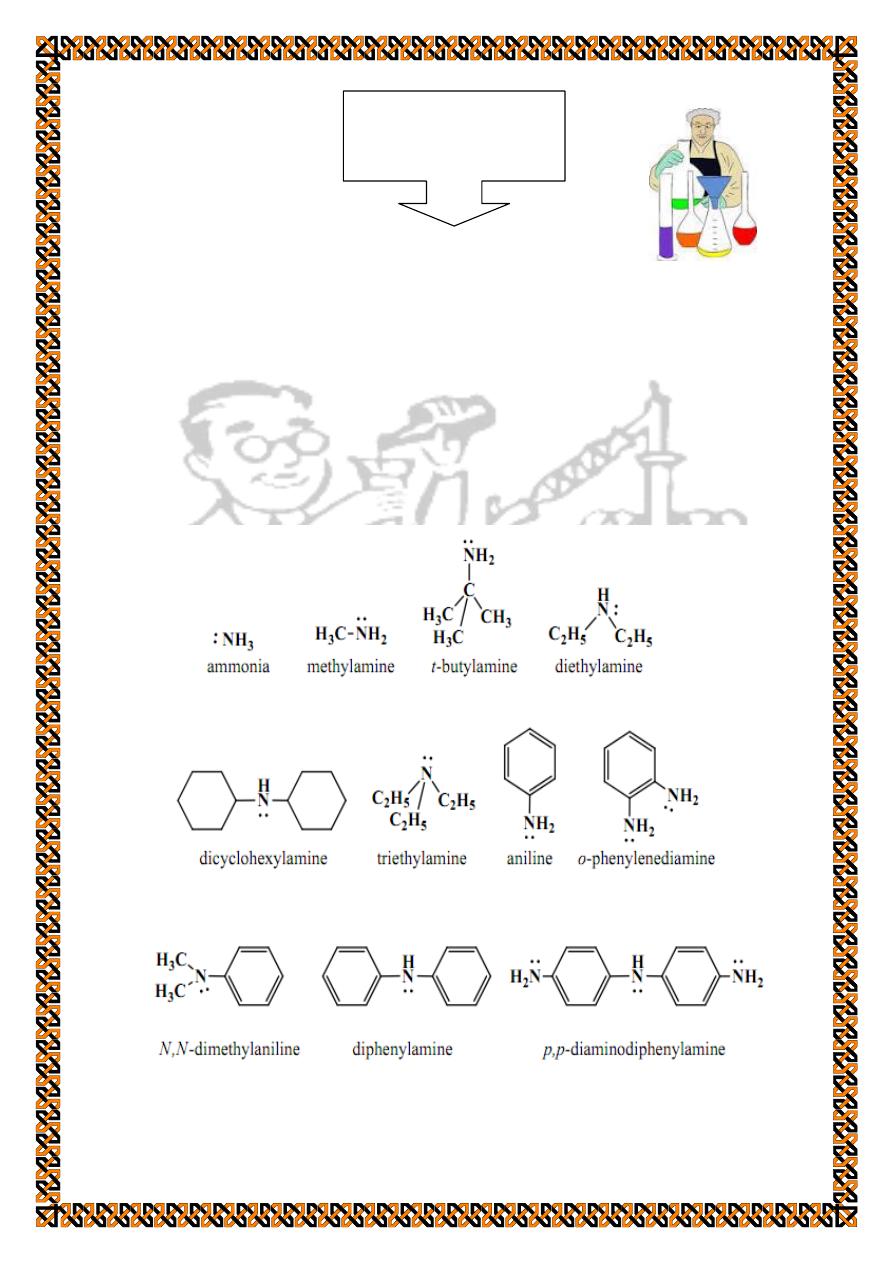
Identification Of Amines
Amines are basic organic compounds that are considered as
derivatives of ammonia. They are classified as primary,
secondary, or tertiary according to the number of groups
attached to the nitrogen atom:
RNH
2
, R
2
NH, or R
3
N respectively where R is any alkyl or aryl
group.
Experiment
No.3

Physical properties
Like ammonia, amines are polar compounds and all of them
can form intermolecular hydrogen bonds except tertiary amines.
They have lower boiling points than alcohols or carboxylic
acids of the same molecular weight but higher boiling points
than non polar compounds . Methylamine is gas while o-
phenylenediamine and p,p-diaminodiphenylmethane are solids.
The others are liquids.
All amines are capable of forming hydrogen bonds with
water, thus those with six carbon atoms or less are quite soluble
in water. They are soluble in organic solvents as ether, alcohol
and benzene.
All of them have fish like odour except the methylamines
and ethylamines which smell just like ammonia.
Aromatic amines are colourless when pure, but they are
easily oxidized by air becoming coloured. They are generally
very toxic and can be absorbed through the skin.
Chemical reactions :
All classes of amines (primary, secondary, and tertiary)
have an unshared pair of electrons on the nitrogen atom, just like
ammonia. That is why they are similar to ammonia in their
chemical behavior (mainly basicity and neocleophilicity).

1. Ramini and Simon tests (Sodium nitroprusside tests).
(conventional Ramini and Simon tests)
In Ramini test the amine reacts with acetone and the
product
interacts
with
sodium
nitroprusside
(Na
2
[Fe(NO)(CN)
5
].2H
2
O) that is dissolved in 50% aqueous
methanolic solution to produce a coloured complex. In Simon
test acetone is replaced by 2.5 M acetaldehyde solution. These
two tests distinguish between primary and secondary aliphatic
amines.
To distinguish between aromatic amines (primary,
secondary and tertiary) the
modified Ramini and Simon tests
are
applied. These tests use the same reagents and procedure of the
conventional tests but the modifications are the replacement of
the methanolic solution of sodium nitroprusside by a solution of
sodium nitroprusside in dimethylsulfoxide (modified sodium
nitroprusside reagent) and the use of a saturated aqueous
solution of zinc chloride instead of water.
Procedure :
Ramini test
To 1 ml of methanolic sodium nitroprusside solution add 1
ml of distilled water, 5 drops of acetone, and about 30 mg of the
amine.
In most cases the characteristic colour appear in a few
seconds, although in some cases 2 minutes may be necessary.
Simon test
Follow the above procedure exactly but use 5 drops of 2.5
M acetaldehyde solution instead of acetone. Up to 2 minutes
may be needed for the colour to develop.
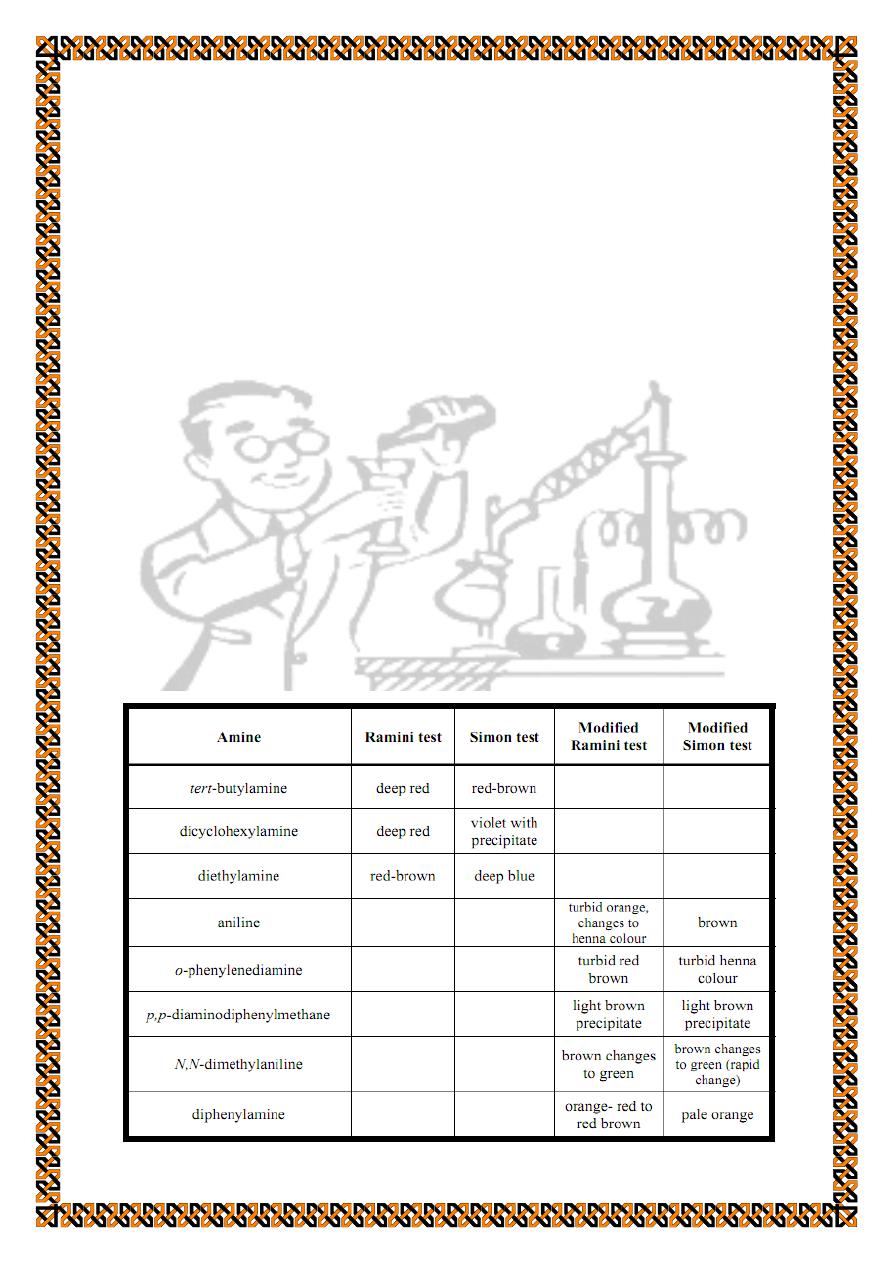
Modified Ramini test
To 1 ml of the modified sodium nitroprusside reagent add 1
ml of saturated aqueous zinc chloride solution, 5 drops of
acetone, and about 30 mg of the amine. Primary and secondary
aromatic amines produce orange-red to red-brown colours
within a period of few seconds to 5 minutes. Tertiary aromatic
amines give a colour that changes from orange-red to green over
a period of about 5 minutes.
Modified Simon test
Follow the above procedure exactly but use 5 drops of 2.5
M acetaldehyde solution instead of acetone. Primary aromatic
amines give an orange-red to red-brown colour within 5
minutes; secondary aromatic amines give a colour changing
from red to purple within 5 minutes; tertiary aromatic amines
give a colour that changes from orange-red to green over a
period of about 5 minutes.
Examples are outlined in the following table:
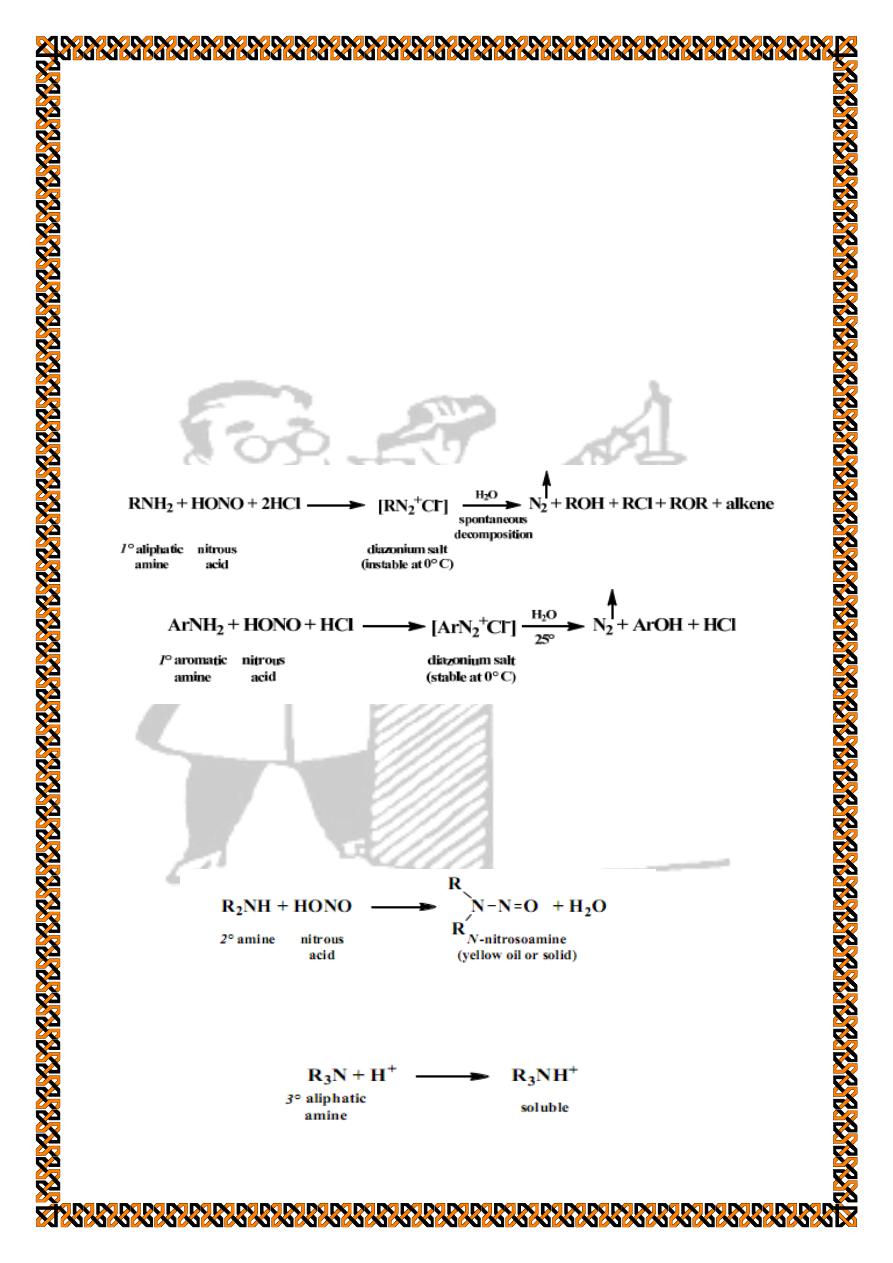
2. Nitrous acid test
The reaction of amines with nitrous acid (HNO
2
) is another
test that classifies the amine not only as primary, secondary, or
tertiary, but also as aliphatic or aromatic.
Primary aromatic and aliphatic amines react with nitrous
acid to form an intermediate diazonium salt. The aliphatic
diazonium salts decompose spontaneously by rapid loss of
nitrogen, particularly when the original amino group is attached
to a secondary or tertiary carbon, while most aromatic
diazonium salts are stable at 0°C but lose nitrogen slowly on
warming to room temperature.
Secondary amines undergo a reaction with nitrous acid to
form N-nitrosoamines, which are usually yellow oils or solids.
These are carcinogenic compounds; therefore, nitrous acid test
is not applied for secondary amines by the students.
Tertiary aliphatic amines do not react with nitrous acid, but
they form a soluble salt.
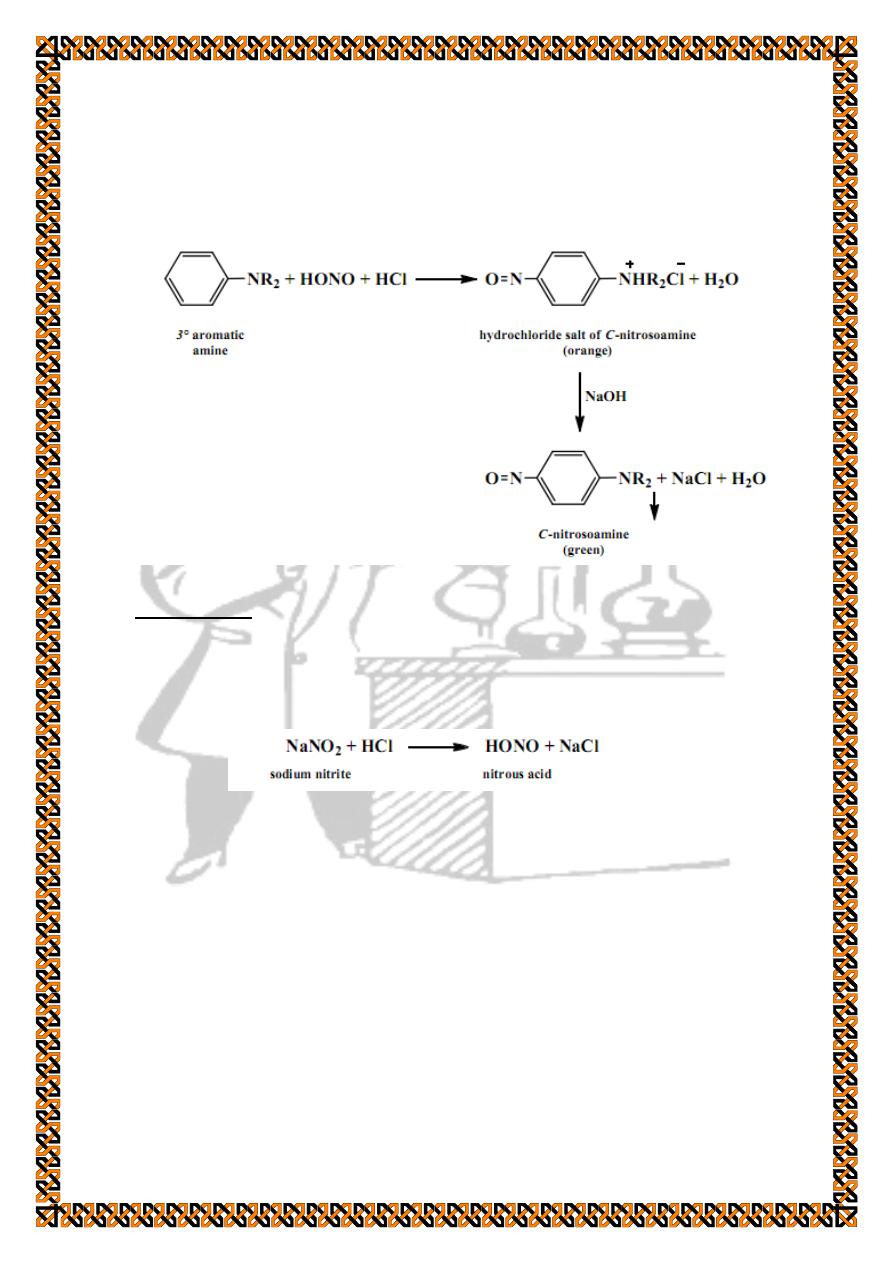
Tertiary aromatic amines react with nitrous acid to form the
orange-colored hydrochloride salt of the C-nitrosoamine.
Treating the solution with base liberates the blue or green C-
nitrosoamine.
Procedure :
Nitrous acid is prepared instantaneously by the reaction of
sodium nitrite and hydrochloric acid :
In a test tube dissolve 0.5 ml or 0.5 g of the amine in a
mixture of 1.5 ml of concentrated hydrochloric acid and 2.5 ml
of water, and cool the solution to 0°C in a beaker of ice. In
another test tube dissolve 0.5 g of sodium nitrite in 2.5 ml of
water, and add this solution drop wise, with shaking to the cold
solution of the amine hydrochloride. Move 2 ml of the final
solution to another test tube, warm gently, and examine for
evolution of gas.
Results :
The observation of rapid bubbling or foaming as the
aqueous sodium nitrite solution is added at 0°C indicates
the presence of a primary aliphatic amine.
The evolution of gas (bubbling) upon warming to room
temperature indicates that the amine is a primary aromatic
amine , and the solution should be subjected to the
coupling reaction (test 3).
If a pale yellow oil (heavier than water) or low-melting
solid, which is the N-nitrosoamine, is formed with no
evolution of gas, the original amine is a secondary amine.
If a dark-orange solution or an orange crystalline solid is
formed, which is the hydrochloride salt of the C-
nitrosoamine, the amine is tertiary aromatic. Treating 2 ml
of this solution with few drops of 10% sodium hydroxide
or sodium carbonate solution produces the bright-green or
-blue nitrosoamine base.
If only solubilization of the amine is obtained with no
other results, the amine is tertiary aliphatic.
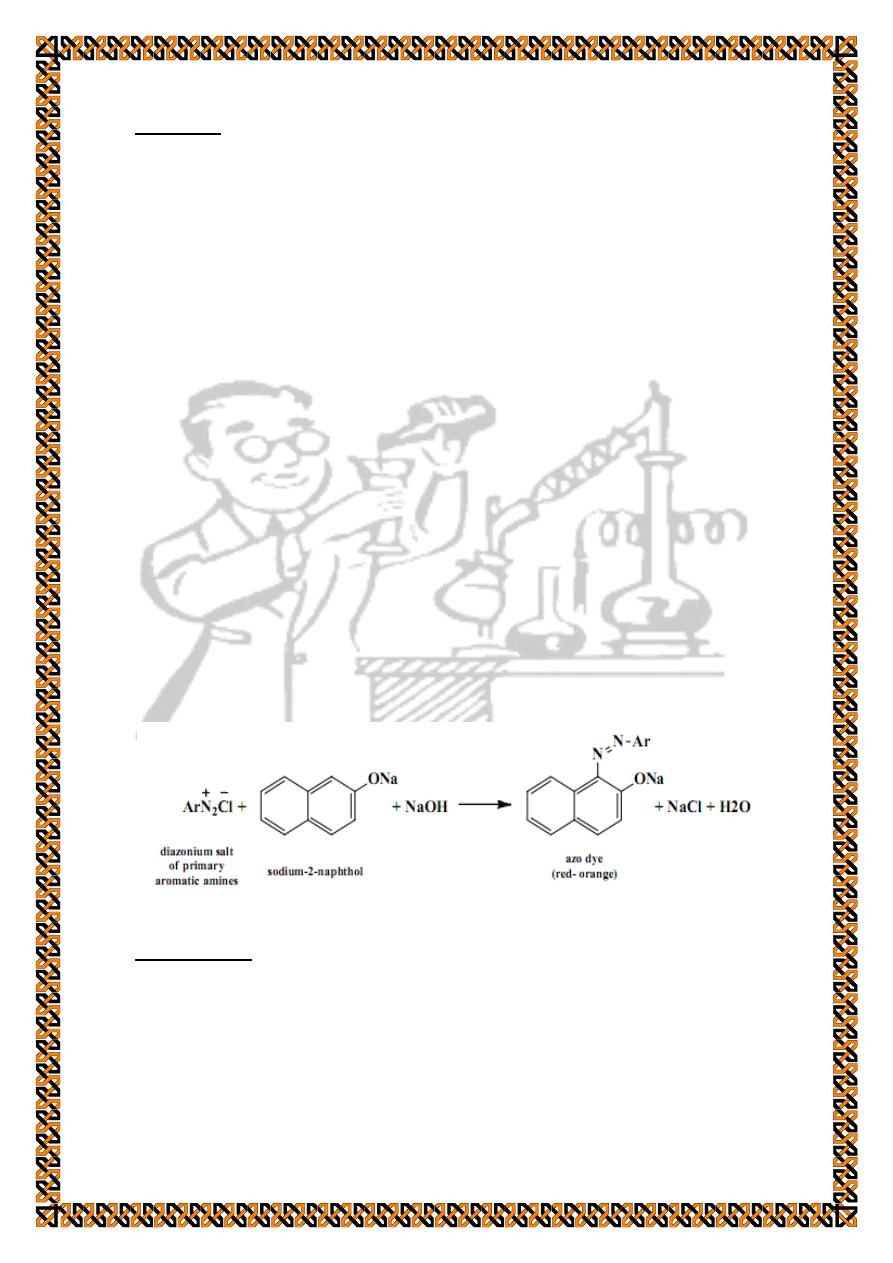
3. Coupling reaction
(a test for primary aromatic amines).
Procedure :
Dissolve 0.1 g of 2-naphthol in a mixture of 2 ml of 10%
sodium hydroxide solution and 5 ml distilled water. Add 2 ml of
the cold diazonium solution and observe the result. The
formation of a red- orange dye (red precipitate in case of
phenol) with evolution of gas only upon warming indicates that
the compound is a primary aromatic amine.

4. Carbon disulfide reagent test
(for secondary aliphatic amines).
Procedure :
In a test tube dissolve 50 mg (1-2 drops) of the amine in 5
ml distilled water (or 1-2 drops of concentrated hydrochloric
acid if necessary). In another test tube mix o.5-1 ml of
concentrated ammonia solution with 1 ml of nickel chloride in
carbon disulfide reagent (NiCl
2
/CS
2
). Add 0.5-1 ml from the
first test tube to the second one. A definite precipitation
indicates that the unknown is a secondary amine. A slight
turbidity is an indication of a trace of a secondary amine as an
impurity.
5. Lignin test
(for primary and secondary aromatic amines).
This test depends on the action of lignin in the newsprint
paper.
Procedure :
Dissolve 10 - 20 mg of the amine in a few drops of ethanol
and moisten a small area of newsprint paper with this solution.
Place 2 drops of 6 N hydrochloric acid on the moistened spot.
The immediate develop of yellow or orange colour is a positive
test for a primary or secondary aromatic amine.

Identification Of Alkyl And Aryl Halides
Physical properties :
All alkyl halides and chlorobenzene are colourless liquids
when pure except iodoform, CHI
3
, which is a yellow crystalline
solid with a characteristic odour. Methyl iodide, ethyl iodide and
bromide, chloroform, and carbon tetrachloride have sweetish
odours. Benzyl chloride has a sharp irritating odour and is
lachrymatory. Chlorobenzene possesses aromatic odour.
Alkyl and aryl halides (R-X , Ar-X) have boiling points
higher than the parent hydrocarbon because of the heavier
molecular weight. Accordingly, for a given compound, iodides
have the higher boiling point than bromides and chlorides.
In spite of their polarity alkyl halides are insoluble in water
due to their inability to form hydrogen bonds. They are soluble
in most organic solvents.
Iodo- , bromo- , and polychloro- compounds are denser than
water.
Experiment
No.4

Chemical reactions :
1. Reaction with alcoholic silver nitrate.
Alcoholic silver nitrate reagent is useful in classifying
halogen compounds. Many halogen containing compounds react
with silver nitrate to give an insoluble silver halide (AgX), and
the rate of this reaction indicates the degree of reactivity of the
halogen atom in the compound. Besides, the identity of the
halogen can sometimes be determined from the colour of the
silver halide produced; silver chloride is white (turns to purple
on exposure to light), silver bromide is pale yellow, and silver
iodide is yellow. These should, of course, be consistent with
results from elemental analysis (sodium fusion for detection of
halogens).
It is obvious that this reaction follows S
N
1 mechanism.
Generally the reactivity of alkyl halides towards this reagent is:
R
3
CX > R
2
CHX > RCH
2
X

Procedure :
Add one drop or a couple of crystals of the unknown to 2
ml of 2% ethanolic silver nitrate solution. If no immediate
reaction is observed, stand for 5 minutes at room temperature
and observe the result. If no reaction takes place, warm the
mixture in water bath for 30 seconds and observe any change. If
there is any precipitate (AgX) add several drops of 1 M nitric
acid solution to it; silver halides are insoluble in this acid.
tert- chlorides, methyl and ethyl iodides, and ethyl bromide
give fast result at room temperature whereas pri- and sec-
chlorides, and benzyl chloride give result only on warming.
Chlorobenzene, chloroform, iodoform and carbon tetrachloride
don't give any positive result.
2. Sodium iodide in acetone test.
This test, complementing the alcoholic silver nitrate test, is
used to classify aliphatic chlorides and bromides as primary,
secondary, or tertiary. This test depends on the fact that sodium
chloride and sodium bromide are only very slightly soluble in
acetone.
The mechanism follows direct displacement (S
N
2)process;
therefore, the order of reactivity of simple halides is :
primary > secondary > tertiary
With sodium iodide, primary bromides give a precipitate of
sodium bromide within 3 min at 25°C, whereas the chlorides
give no precipitate and must be heated to 50°C in order to effect
a reaction. Secondary and tertiary bromides react at 50°C, but
the tertiary chlorides fail to react within the time specified.
Tertiary chlorides will react if the test solutions are allowed to
stand for a day or two.
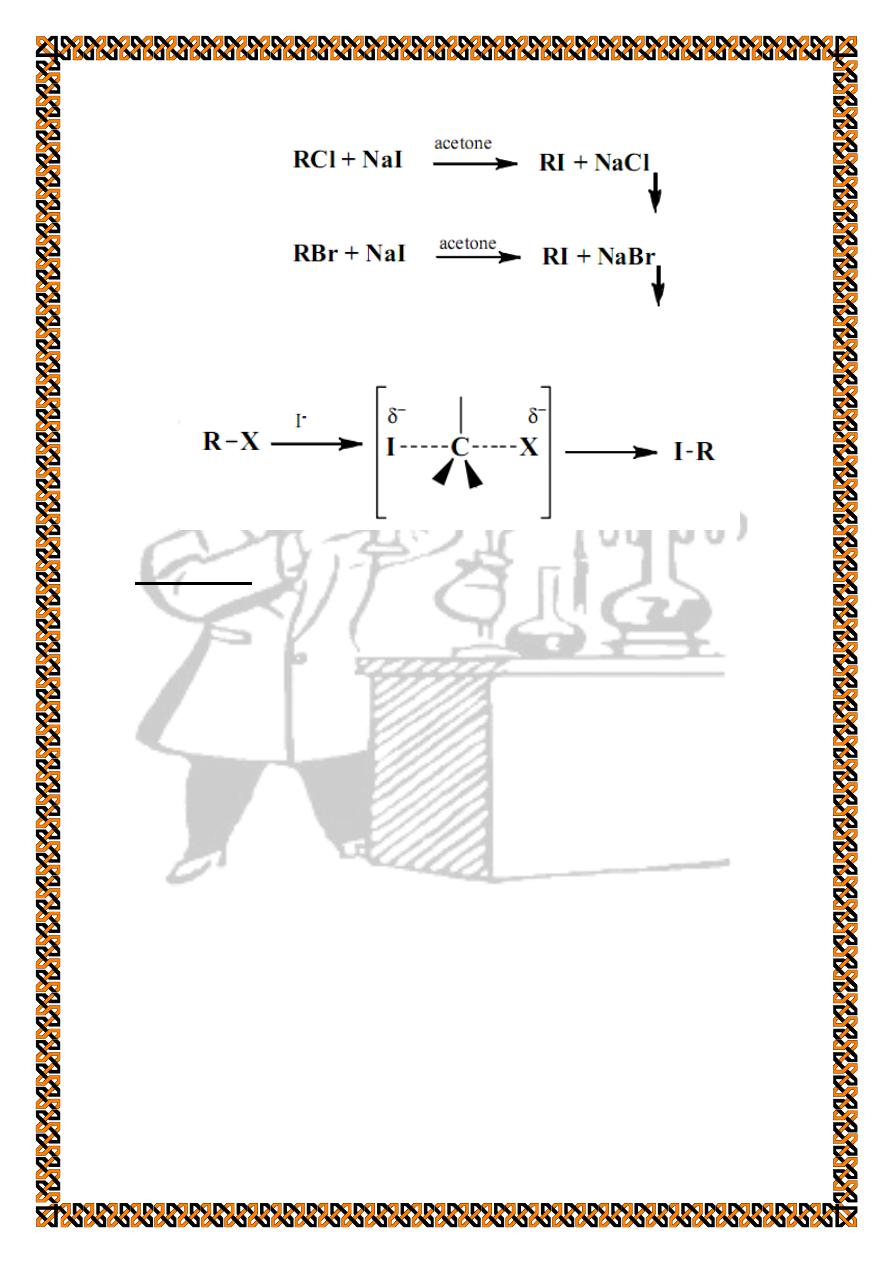
These results are consistent with the following S
N
2 process:
Procedure :
To 1 ml of the sodium iodide-acetone reagent in a test tube
add two drops of the compound. If the compound is a solid,
dissolve about 0.1 g in the smallest possible volume of acetone,
and add the solution to the reagent. Shake the test tube, and
allow the solution to stand at room temperature for 3 min. Note
whether a precipitate is formed and also whether the solution
turns reddish brown, because of the liberation of free iodine. If
no change occurs at room temperature, place the test tube in
water bath at 50°C.Excessive heating causes loss of acetone and
precipitation of sodium iodide, which can lead to false-positive
results. At the end of 6 min, cool to room temperature and note
whether a reaction has occurred. Occasionally, a precipitate
forms immediately after combination of the reagents; this
represents a positive test only if the precipitate remains after the
mixture is shaken and allowed to stand for 3 minutes.

3. Differentiation between alkyl and aryl halides
(Formaldehyde- sulfuric acid test)
With this test aryl halides (chlorobenzene) produce pink,
red, or bluish red colour whereas alkyl halides produce yellow,
amber, or brown colour.
Procedure :
This reagent is prepared at the time of use by adding 1 drop
of formaldehyde to a test tube containing 1 ml concentrated
sulfuric acid. In another test tube add 1 drop of the compound to
be tested to 1 ml of hexane. From this solution take 1-2 drops
and add them to 1 ml of the reagent. Shake well and observe the
colour.
4. Special tests for chloroform
a) Riemer- Tiemann reaction
For
procedure
and
chemical
equations
refer
to
"Identification of Phenols" experiment. Resorcinol results in a
red colour with slight fluorescence in the aqueous layer while α-
or β- naphthol results in a deep blue aqueous layer fading to
green.
b) Reduction of Fehling's reagent
For preparation of Fehling's reagent and chemical equations
refer to "Identification of Aldehydes and Ketones" experiment.
Boil 1 ml of chloroform gently (water bath) with 3 ml of
Fehling's reagent with constant shaking for 3 - 4 minutes.
Reduction occurs and reddish cuprous oxide slightly separates.
Benzimidazole
Introduction :
Benzimidazole is a fused aromatic imidazole ring system
where a benzene ring is fused to the 4 and 5 positions of an
imidazole ring. Benzimidazole is also known as 1,3-
benzodiazoles they possess both acidic and basic characteristics.
The NH group present in benzimidazole is relatively strongly
acidic and also weakly basic. Another characteristic of
benzimidazole is that they have the capacity to form salts.
Benzimidazole is a bicyclic heterocycle system consisting
of two nitrogen atoms and fused phenyl ring shows wide range
of biological activities.. Benzimidazole posses wide spectrum of
biological activities including antibacterial , antifungal ,
antiviral, anti-inflammatory , anticonvulsant , antidepressant ,
antihypertensive , analgesic , and hypoglycemic properties.
Benzimidazole
can
be
synthesized
using
o-
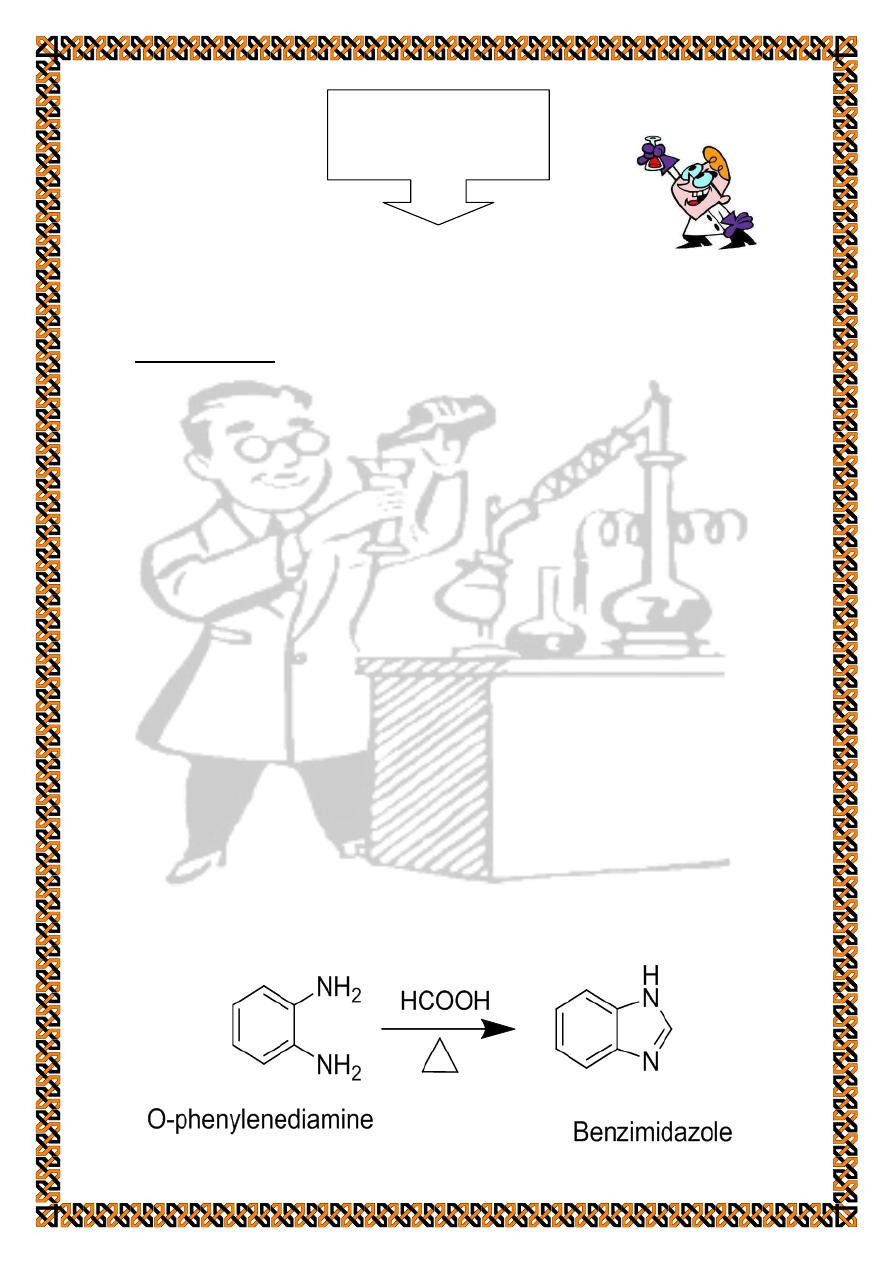
phenylenediamine and carboxylic acid. The reaction proceeds
via the acyl derivatives which cyclizes under the influence of
excess acid.
Experiment
No.5

Procedure :
A mixture of o-Phenylenediamine (10 g ) with 90% formic
acid (40 ml) , placed in a 100 ml round bottom flask , heat at
C on water bath for (1 - 2 hrs.) cool , dilute the reaction
mixture with 20 ml cold water and add with stirring , dilute
sodium hydroxide solution until the mixture is alkaline .Collect
the precipitated solid on bucchnner funnel and wash with cold
water. Recrystallize from hot water and collect white crystals of
benzimidazole m.p 170 - C.
Calculation :
O-Phenylene diamine Benzimidazole
C
6
H
8
N
2
C
7
H
6
N
2
108 118
10 g X
X = 10.9209 gm theoretical wt.
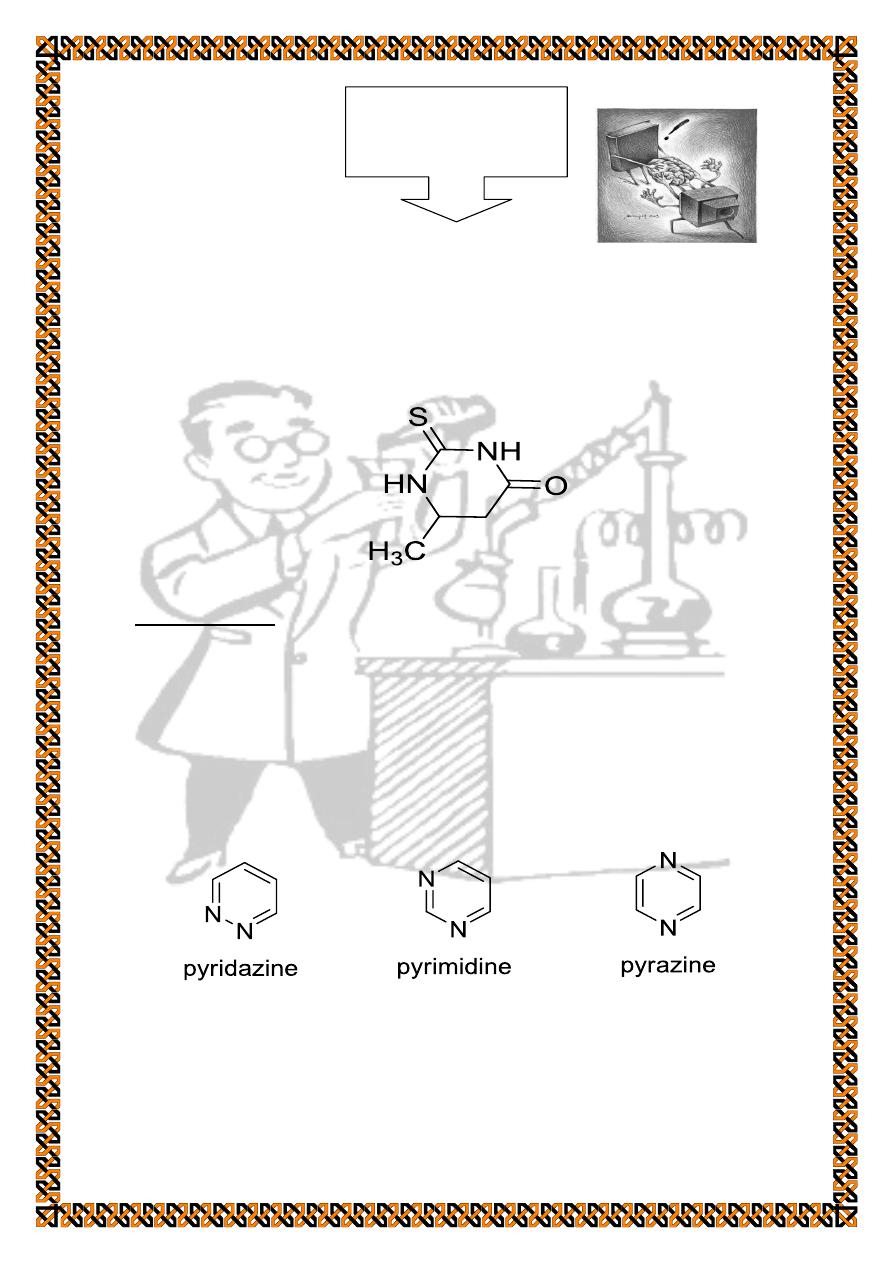
Synthesis of 6- methyl 4- oxo- 1,2,3,4 tetrahydro - 2 -
thiopyrimidine
Introduction :
Pyrimidine is an aromatic heterocyclic organic compound
similar to pyridine. One of the three diazines, (6-membered
heterocyclics with two nitrogen atoms in the rings) , it has the
nitrogen atoms at positions 1 and 3 in the ring . The other
diazines are pyrazine (nitrogen 1 and 4 ) and pyridazine
(nitrogen 1 and 2).
The pyrimidine ring system has wide occurrence in
nature as substituted and ring fused compounds and derivatives,
including the nucleotides , thiamine (vitamin B
1
) and alloxane.
Experiment
No.6
It is also found in many synthetic compounds such
as barbiturates . Although pyrimidine derivatives such as uric
acid and alloxane were known in the early 19 th century. The
general pyrimidine synthesis involves the condensation of urea
or urea derivatives with β-dicarbonyl compounds .
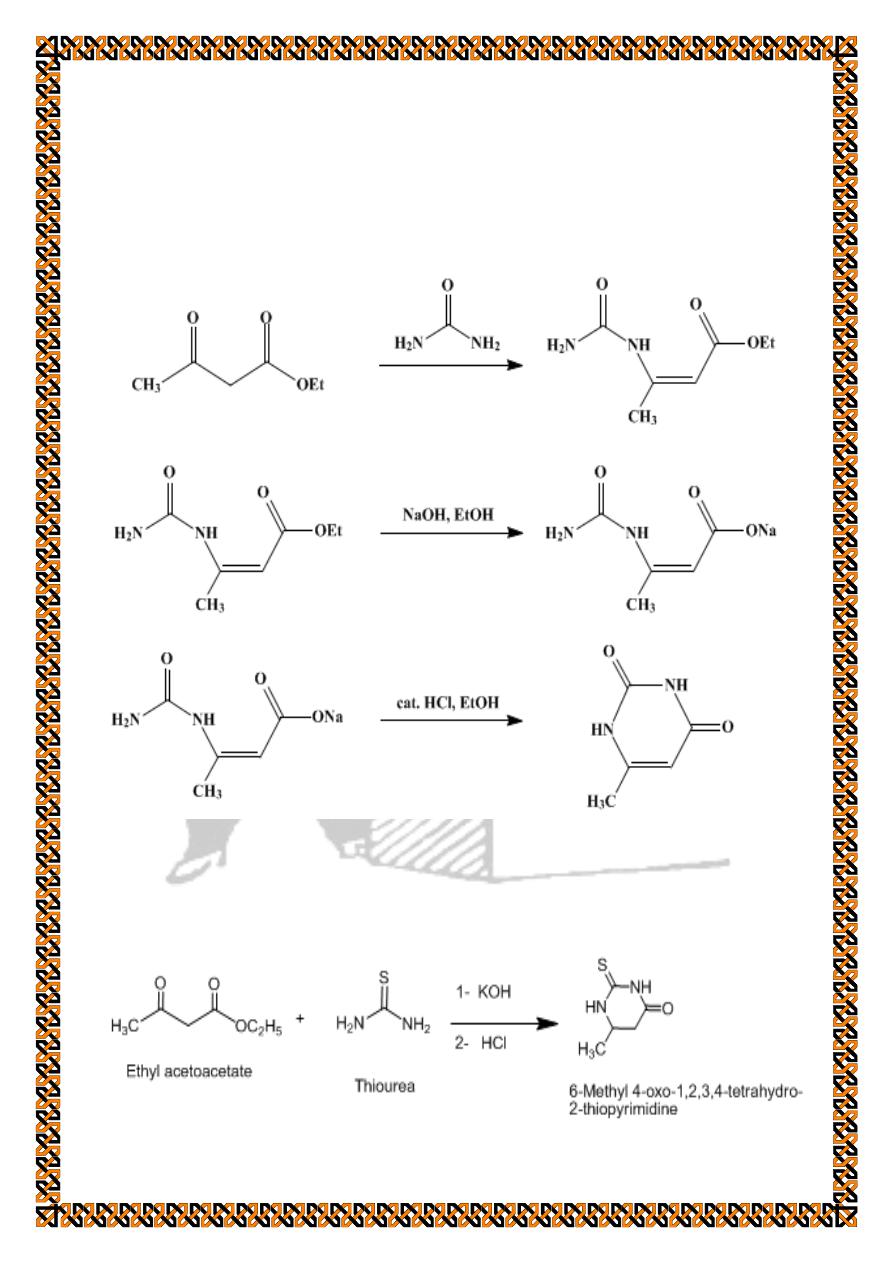
The reaction of thiourea with ethyl acetoacetate yield 6-
methyl4-oxo-1,2,3,4-tetrahydro-2-thiopyrimidine.

Procedure :
To a mixture of thiourea (7.6 g ) and ethyl acetoacetate
(14.8 ml ) in ethanol (10 ml) in a 100 ml . round bottomed
flask,carefully add a solution of KOH ( 6.5 g ) in 4 ml water
with stirring, and heat the mixture under reflux for 2 hours
acidify the resulting crystalline mass by cautious addition of
solution of concentrated HCl (20 ml) in water (10 ml) , then
cool and filter off the product.
6- methyl 4- oxo- 1,2,3,4- tetrahydro -2- thiopyrimidine is
obtained as white crystals elting point C yield 10-12 g
(70-85 % )
Calculation :
Ethyl acetoacetate 6-methyl 4-oxo-1,2,3,4-tetrahydro-
2-thiopyrimidine
C
6
H
10
O
3
C
5
H
8
N
2
OS
130.14 144.19
Wt = (14.8ml×1.02) g X
X = 16.725 g theoretical wt.
