
Chapter 12 - 1
Chapter 12: Structures & Properties of
Ceramics
ISSUES TO ADDRESS...
• How do the crystal structures of ceramic materials
differ from those for metals?
• How do point defects in ceramics differ from those
defects found in metals?
• How are impurities accommodated in the ceramic lattice?
• How are the mechanical properties of ceramics
measured, and how do they differ from those for metals?
• In what ways are ceramic phase diagrams different from
phase diagrams for metals?
Chapter 12 - 2
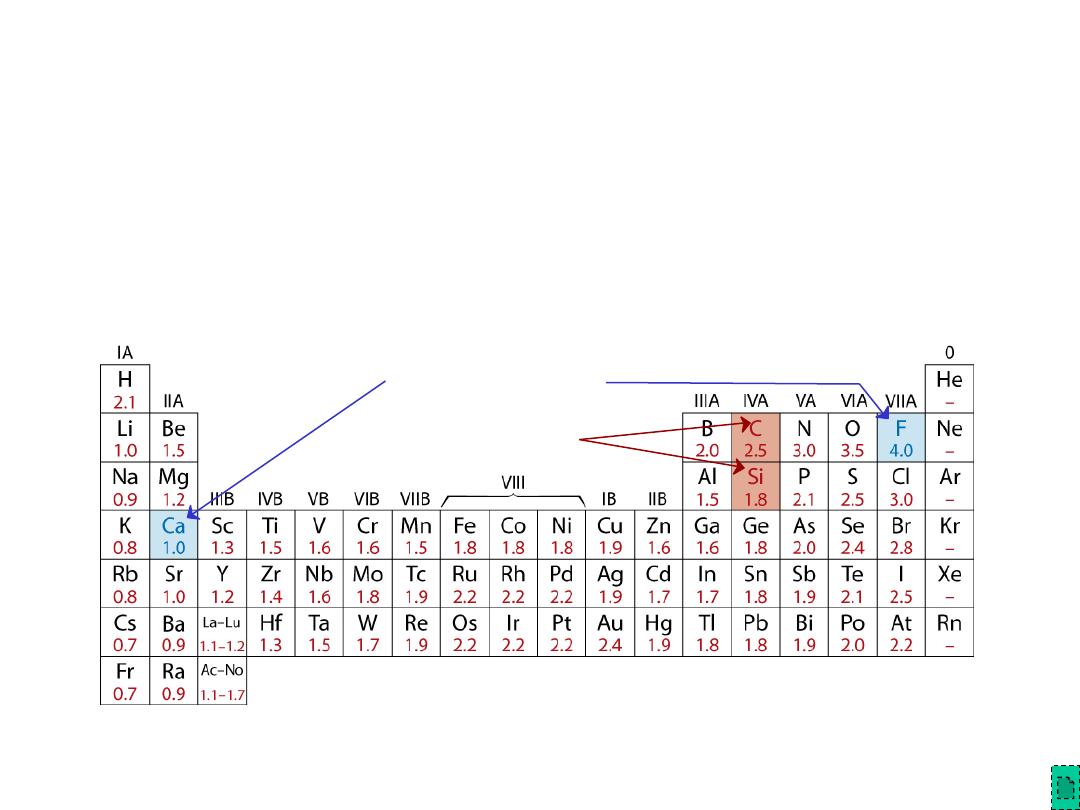
• Bonding:
-- Can be ionic and/or covalent in character.
-- % ionic character increases with difference in
electronegativity of atoms.
Adapted from Fig. 2.7, Callister & Rethwisch 8e. (Fig. 2.7 is adapted from Linus Pauling, The Nature of the
Chemical Bond, 3rd edition, Copyright 1939 and 1940, 3rd edition. Copyright 1960 by
Cornell University.)
• Degree of ionic character may be large or small:
Atomic Bonding in Ceramics
SiC: small
CaF
2
: large

Chapter 12 - 3
Ceramic Crystal Structures
Oxide structures
– oxygen anions larger than metal cations
– close packed oxygen in a lattice (usually FCC)
– cations fit into interstitial sites among oxygen ions
Chapter 12 - 4
Factors that Determine Crystal Structure
1.
Relative sizes of ions
– Formation of stable structures:
--maximize the # of oppositely charged ion neighbors.
Adapted from Fig. 12.1,
Callister & Rethwisch 8e.
-
-
-
-
+
unstable
-
-
-
-
+
stable
-
-
-
-
+
stable
2.
Maintenance of
Charge Neutrality
:
--Net charge in ceramic
should be zero.
--Reflected in chemical
formula:
CaF 2 :
Ca
2+
cation
F
-
F
-
anions
+
A
m
X
p
m, p values to achieve charge neutrality
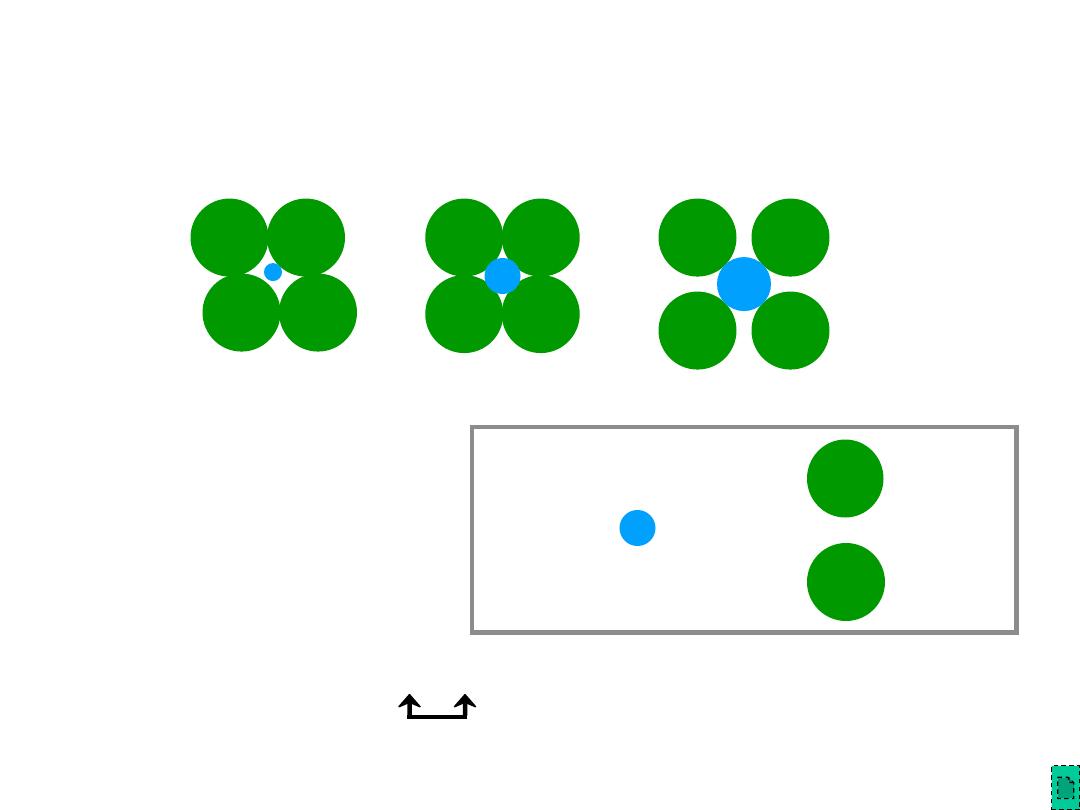
Chapter 12 - 5
• Coordination # increases with
Coordination # and Ionic Radii
Adapted from Table 12.2,
Callister & Rethwisch 8e.
2
r cation
r anion
Coord
#
< 0.155
0.155 - 0.225
0.225 - 0.414
0.414 - 0.732
0.732 - 1.0
3
4
6
8
linear
triangular
tetrahedral
octahedral
cubic
Adapted from Fig. 12.2,
Callister & Rethwisch 8e.
Adapted from Fig. 12.3,
Callister & Rethwisch 8e.
Adapted from Fig. 12.4,
Callister & Rethwisch 8e.
ZnS
(zinc blende)
NaCl
(sodium
chloride)
CsCl
(cesium
chloride)
r
cation
r
anion
To form a stable structure, how many anions can
surround around a cation?
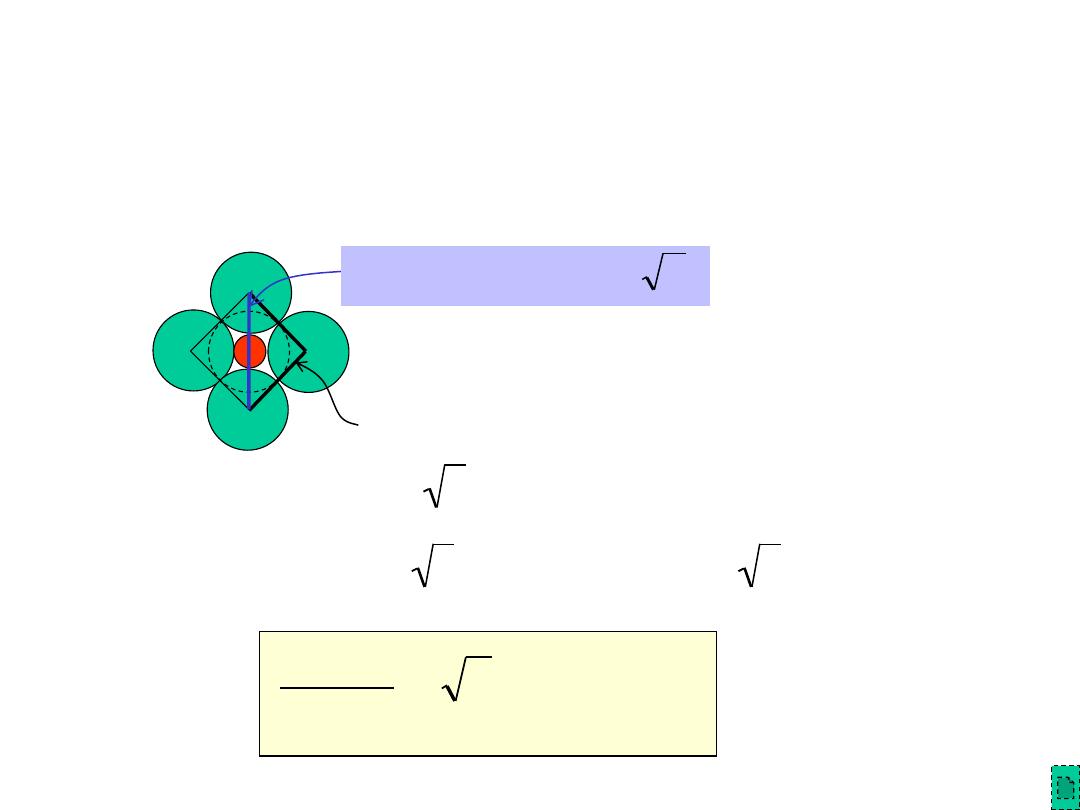
Chapter 12 - 6
Computation of Minimum Cation-Anion
Radius Ratio
• Determine minimum r
cation
/r
anion
for an octahedral site
(C.N. = 6)
a
=
2r
anion
2r
anion
2r
cation
=
2 2r
anion
r
anion
r
cation
=
2r
anion
r
cation
=
( 2
1)r
anion
a
r
r
2
2
2
cation
anion
=
414
.
0
1
2
anion
cation
=
=
r
r

Chapter 12 - 7
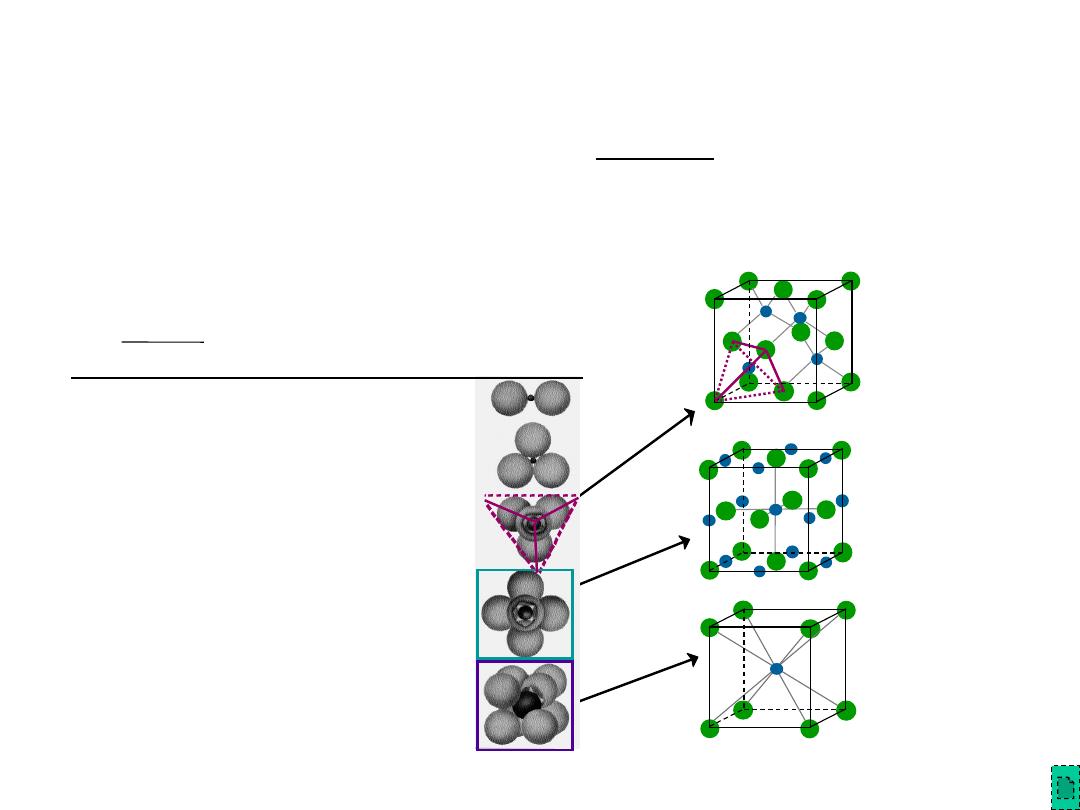
Bond Hybridization
Bond Hybridization
is possible when there is significant
covalent bonding
–
hybrid electron orbitals form
–
For example for SiC
•
X
Si
= 1.8 and X
C
= 2.5
% ionic character
=
100 {1- exp[-0.25(X
Si
X
C
)
2
]}
=
11.5%
• ~ 89% covalent bonding
• Both Si and C prefer sp
3
hybridization
• Therefore, for SiC, Si atoms occupy tetrahedral sites

Chapter 12 - 8
• On the basis of ionic radii, what crystal structure
would you predict for FeO?
• Answer:
550
0
140
0
077
0
anion
cation
.
.
.
r
r
=
=
based on this ratio,
-- coord # = 6 because
0.414 < 0.550 < 0.732
-- crystal structure is NaCl
Data from Table 12.3,
Callister & Rethwisch 8e.
Example Problem:
Predicting the Crystal
Structure of FeO
Ionic radius (nm)
0.053
0.077
0.069
0.100
0.140
0.181
0.133
Cation
Anion
Al
3+
Fe
2
+
Fe
3+
Ca
2+
O
2-
Cl
-
F
-
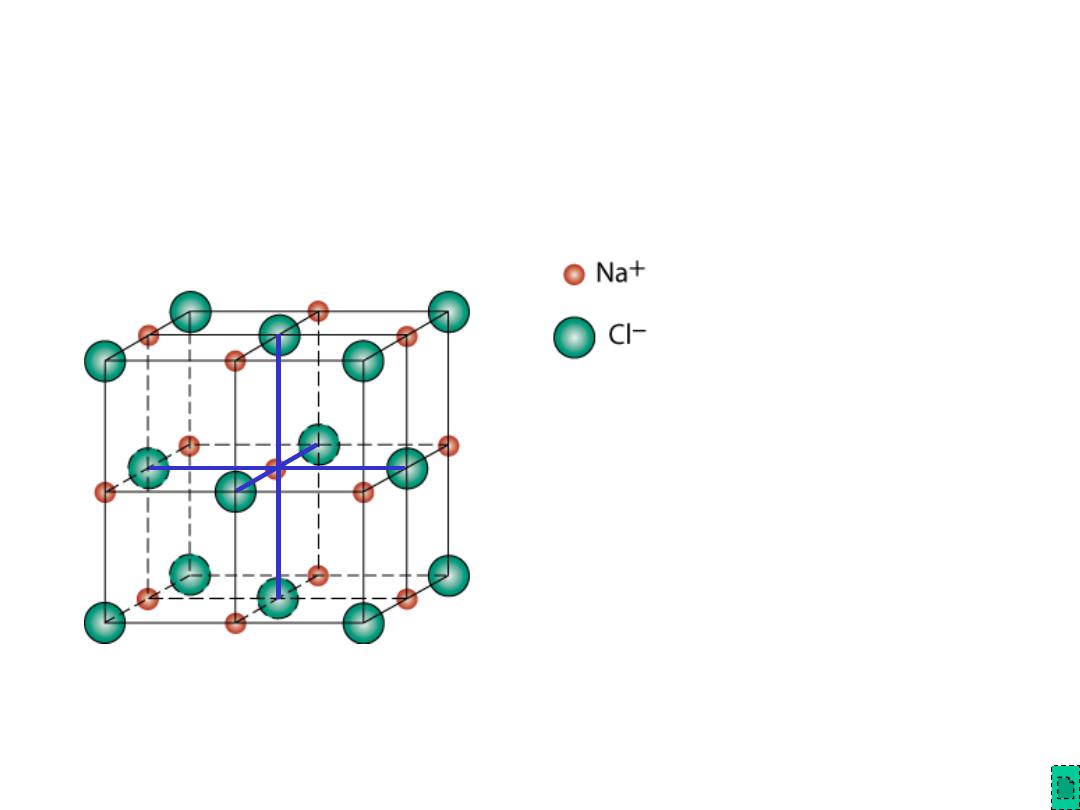
Chapter 12 - 9
Rock Salt Structure
Same concepts can be applied to ionic solids in general.
Example: NaCl (rock salt) structure
r
Na
= 0.102 nm
r
Na
/r
Cl
= 0.564
cations (Na
+
) prefer octahedral
sites
Adapted from Fig. 12.2,
Callister & Rethwisch 8e.
r
Cl
= 0.181 nm
Chapter 12 - 10
MgO and FeO
O
2-
r
O
= 0.140 nm
Mg
2+
r
Mg
= 0.072 nm
r
Mg
/r
O
= 0.514
cations prefer octahedral sites
So each Mg
2+
(or Fe
2+
) has 6 neighbor oxygen atoms
Adapted from Fig. 12.2,
Callister & Rethwisch 8e.
MgO and FeO also have the NaCl structure
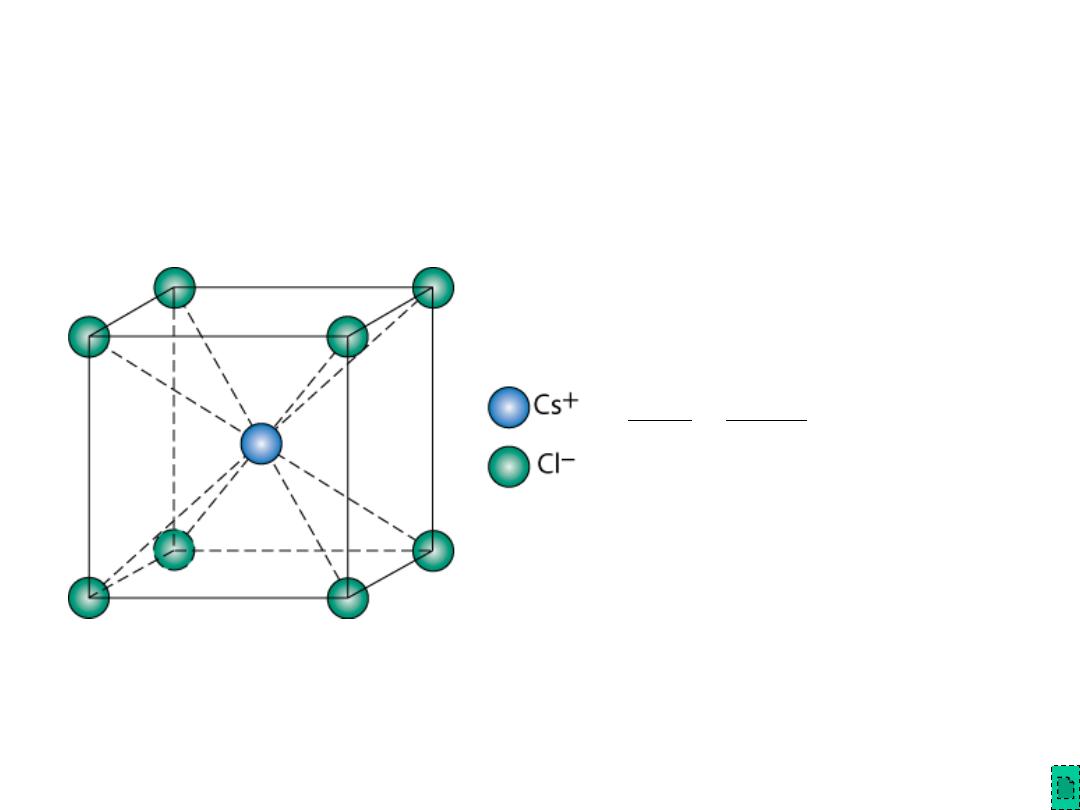
Chapter 12 - 11
AX Crystal Structures
939
.
0
181
.
0
170
.
0
Cl
Cs
=
=
r
r
Adapted from Fig. 12.3,
Callister & Rethwisch 8e.
Cesium Chloride
structure:
Since 0.732 < 0.939 < 1.0,
cubic
sites preferred
So each Cs
+
has 8 neighbor Cl
-
AX
–Type Crystal Structures include NaCl, CsCl, and zinc blende
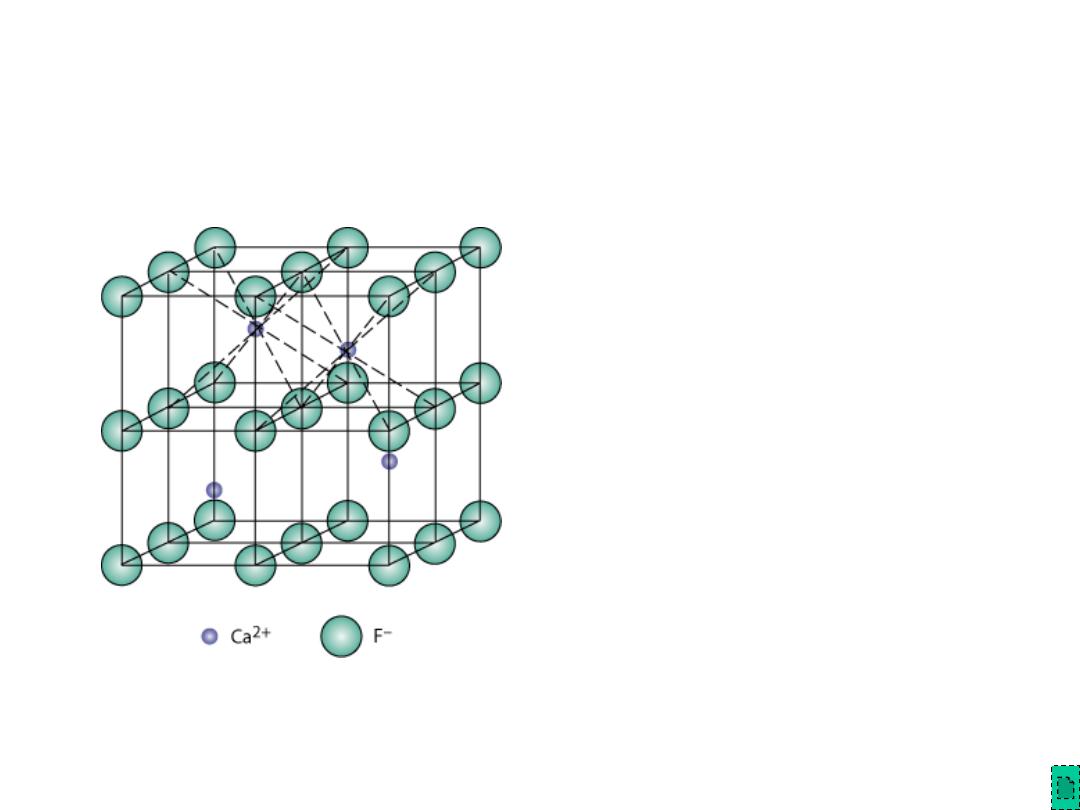
Chapter 12 - 12
AX
2
Crystal Structures
• Calcium Fluorite (CaF
2
)
• Cations in cubic sites
• UO
2,
ThO
2
, ZrO
2
, CeO
2
• Antifluorite structure –
positions of cations and
anions reversed
Adapted from Fig. 12.5,
Callister & Rethwisch 8e.
Fluorite
structure
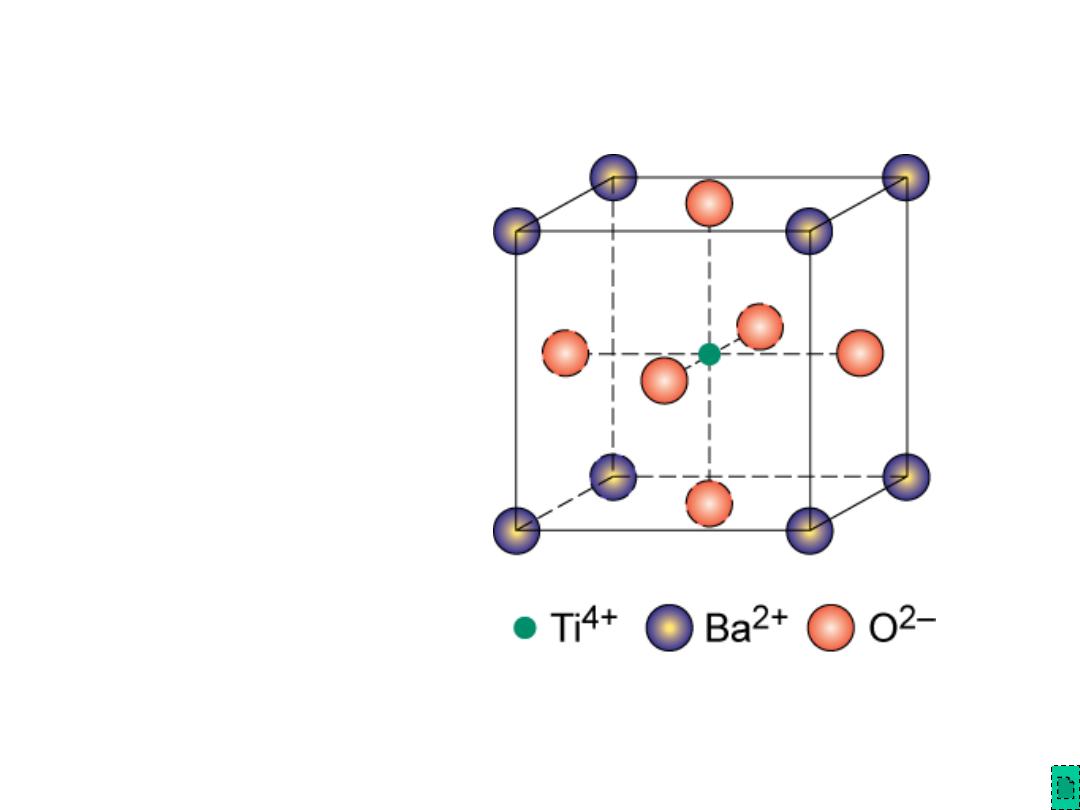
Chapter 12 - 13
ABX
3
Crystal Structures
Adapted from Fig. 12.6,
Callister & Rethwisch 8e.
• Perovskite
structure
Ex: complex oxide
BaTiO
3
Chapter 12 - 14
Density Computations for Ceramics
A
A
C
)
(
N
V
A
A
n
C
=
Number of formula units/unit cell
Volume of unit cell
Avogadro’s number
= sum of atomic weights of all anions in formula unit
A
A
A
C
= sum of atomic weights of all cations in formula unit
Chapter 12 - 15
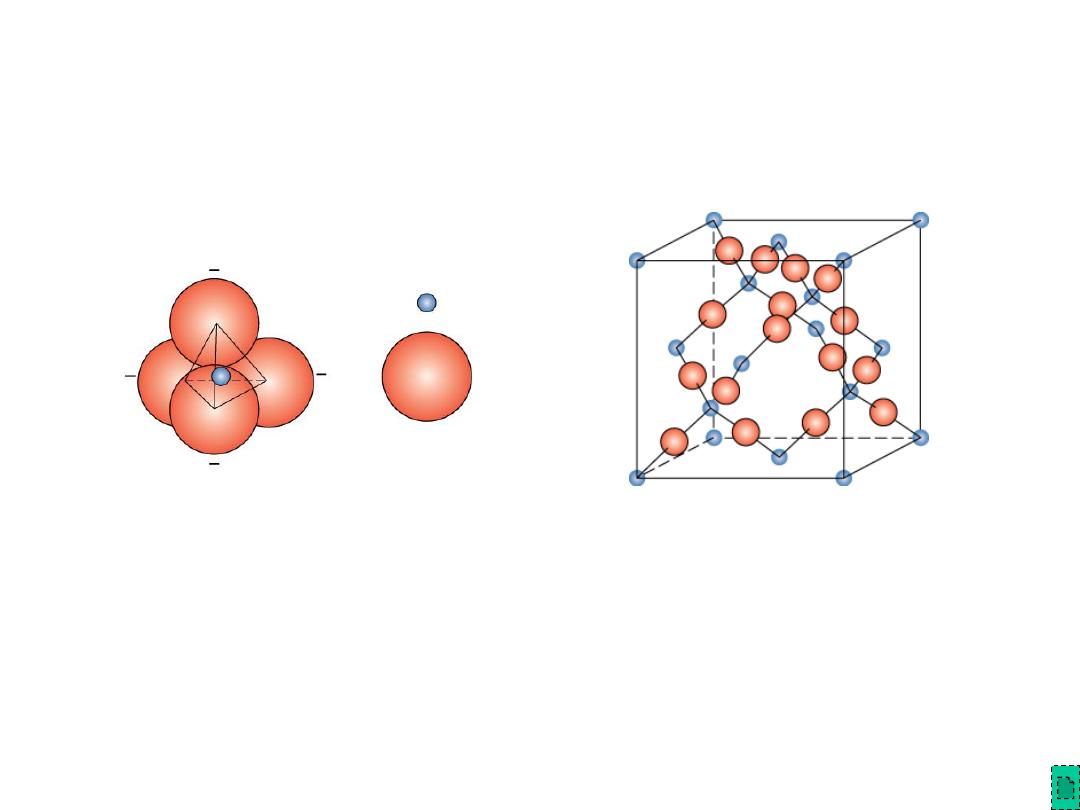
Silicate Ceramics
Most common elements on earth are Si & O
• SiO
2
(silica)
polymorphic
forms are quartz,
crystobalite, & tridymite
• The strong Si-O bonds lead to a high melting
temperature (1710
ºC) for this material
Si
4+
O
2-
Adapted from Figs.
12.9-10, Callister &
Rethwisch 8e
crystobalite
Chapter 12 - 16
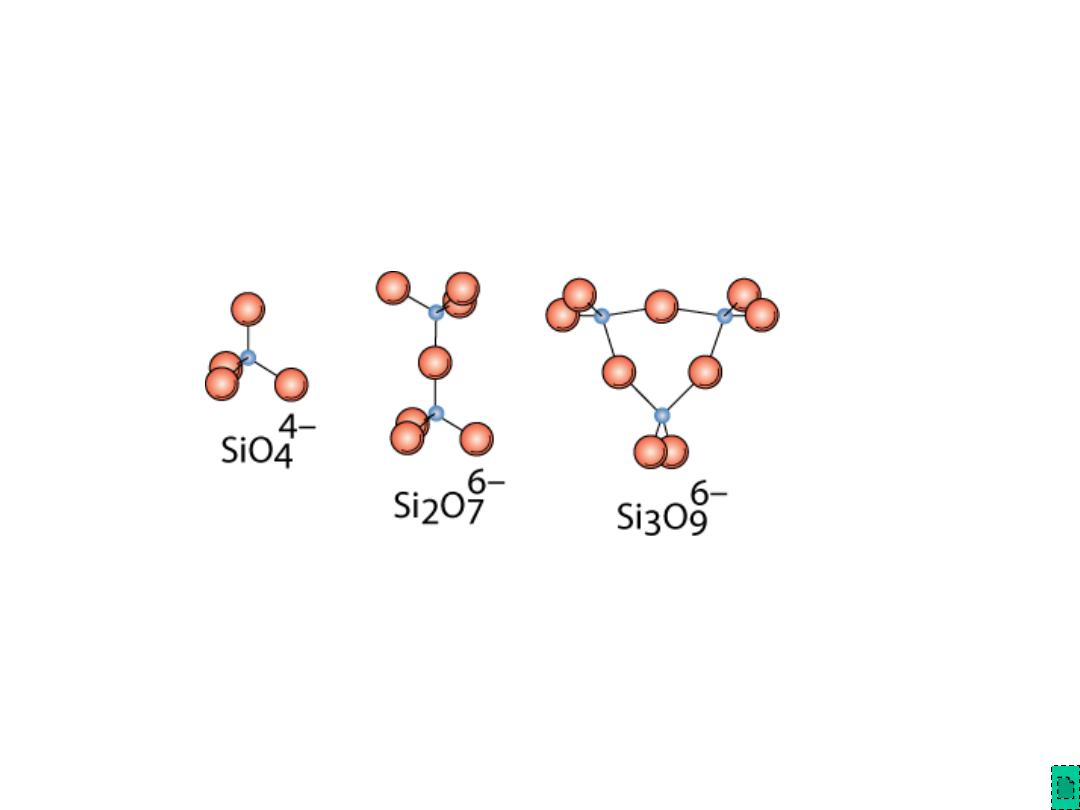
Bonding of adjacent SiO
4
4-
accomplished by the
sharing of common corners, edges, or faces
Silicates
Mg
2
SiO
4
Ca
2
MgSi
2
O
7
Adapted from Fig.
12.12, Callister &
Rethwisch 8e.
Presence of cations such as Ca
2+
, Mg
2+
, & Al
3+
1. maintain charge neutrality, and
2. ionically bond SiO
4
4-
to one another
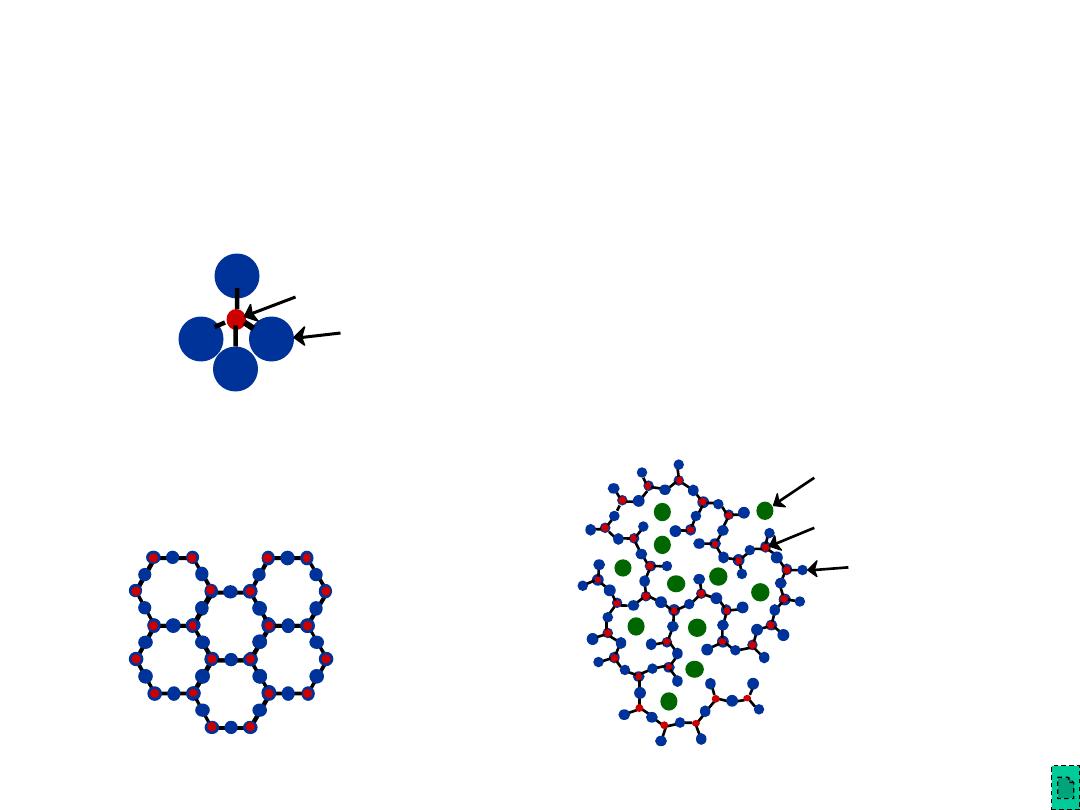
Chapter 12 - 17
• Quartz is
crystalline
SiO
2
:
• Basic Unit:
Glass is noncrystalline (
amorphous)
• Fused silica is SiO
2
to which no
impurities have been added
• Other common glasses contain
impurity ions such as Na
+
, Ca
2+
,
Al
3+
, and B
3+
(soda glass)
Adapted from Fig. 12.11,
Callister & Rethwisch 8e.
Glass Structure
Si0 4 tetrahedron
4-
Si
4+
O
2
-
Si
4+
Na
+
O
2
-
Chapter 12 - 18
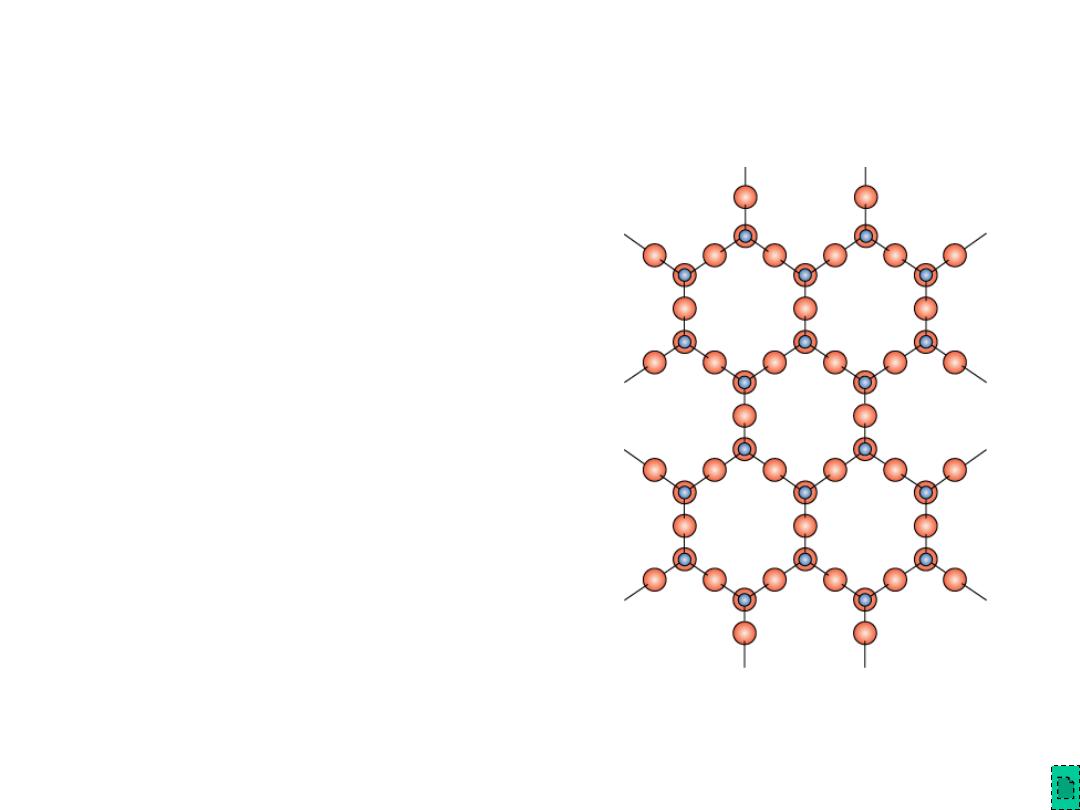
Layered Silicates
• Layered silicates (e.g., clays, mica, talc)
– SiO
4
tetrahedra connected
together to form 2-D plane
• A net negative charge is associated
with each (Si
2
O
5
)
2-
unit
• Negative charge balanced by
adjacent plane rich in positively
charged cations
Adapted from Fig.
12.13, Callister &
Rethwisch 8e.
Chapter 12 - 19
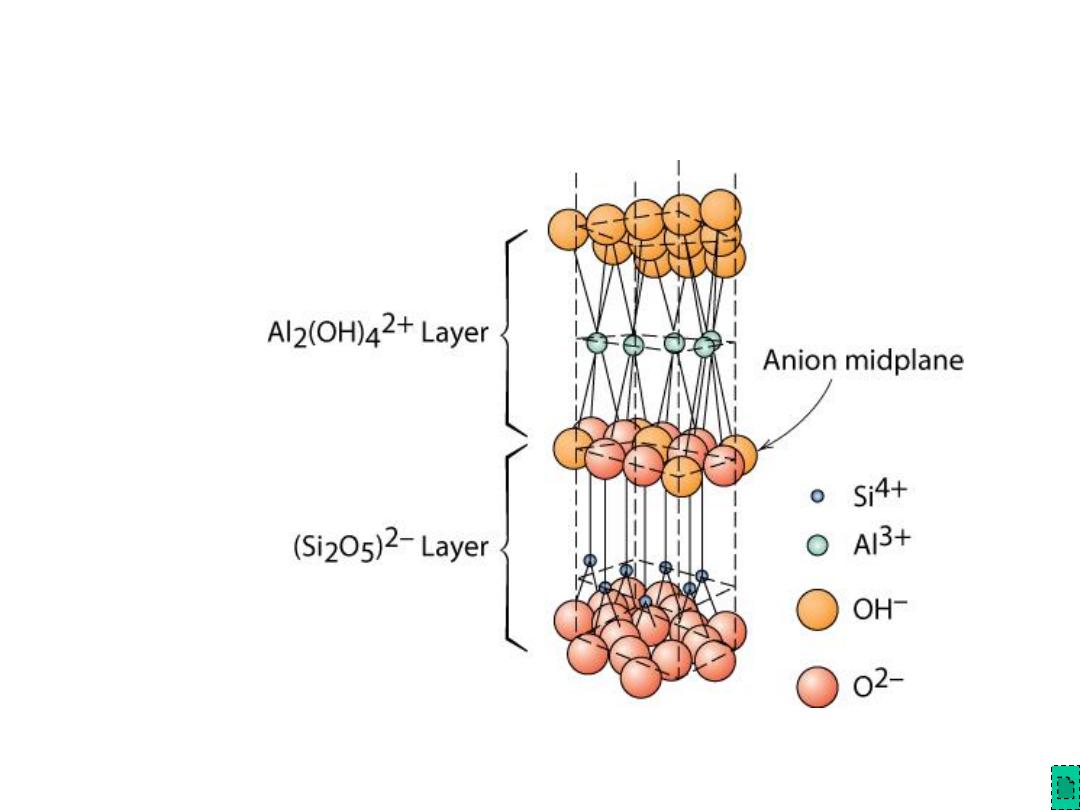
• Kaolinite clay alternates (Si
2
O
5
)
2-
layer with Al
2
(OH)
4
2+
layer
Layered Silicates (cont.)
Note: Adjacent sheets of this type are loosely bound to
one another by van der Waal’s forces.
Adapted from Fig. 12.14,
Callister & Rethwisch 8e.
Chapter 12 - 20
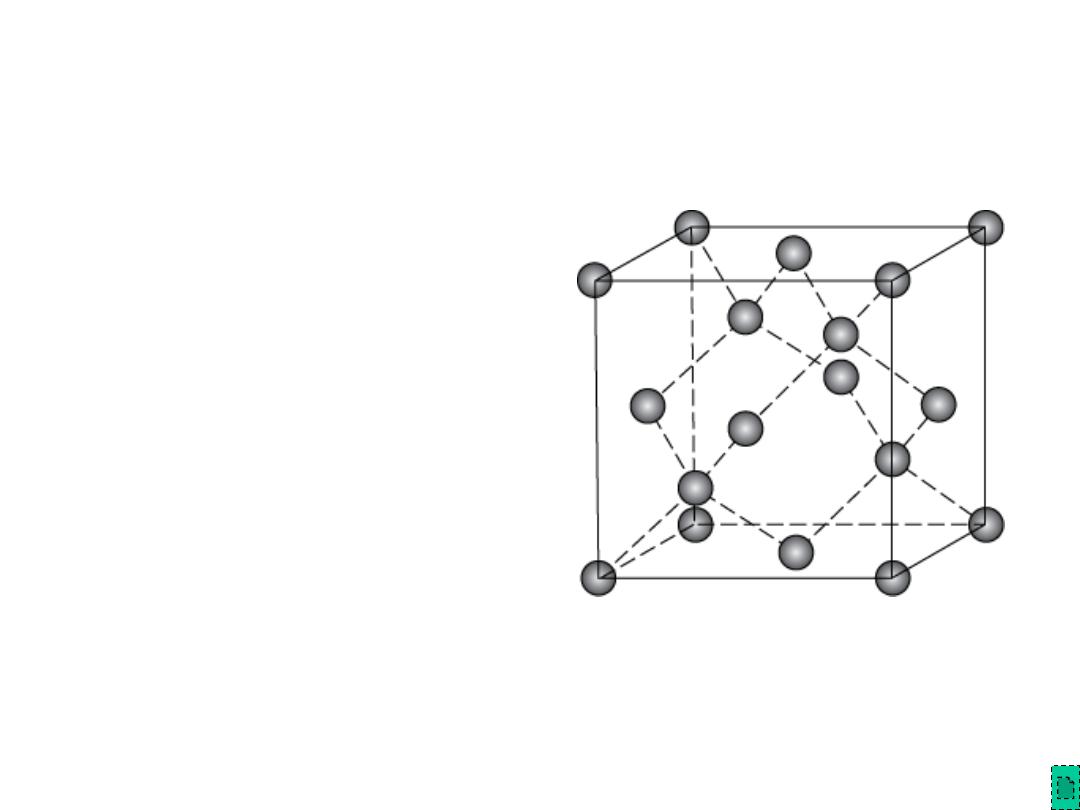
Polymorphic Forms of Carbon
Diamond
– tetrahedral bonding of
carbon
• hardest material known
• very high thermal
conductivity
– large single crystals –
gem stones
– small crystals – used to
grind/cut other materials
– diamond thin films
• hard surface coatings –
used for cutting tools,
medical devices, etc.
Adapted from Fig. 12.15,
Callister & Rethwisch 8e.
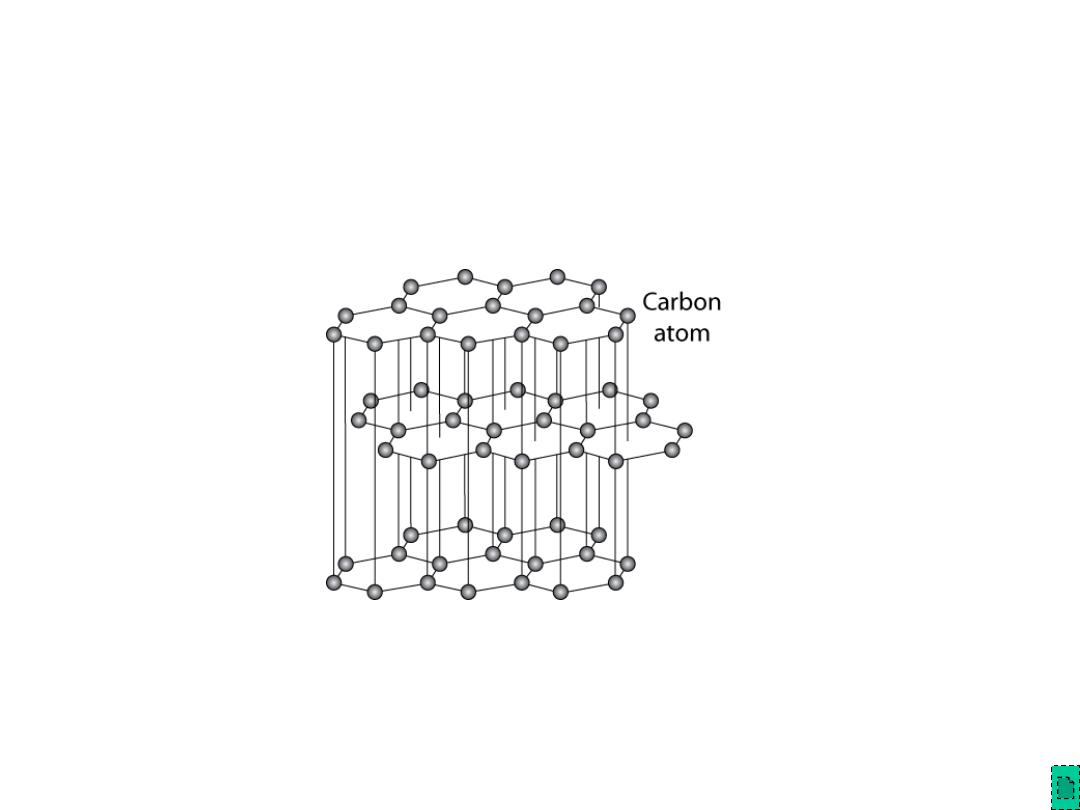
Chapter 12 - 21
Polymorphic Forms of Carbon (cont)
Graphite
– layered structure – parallel hexagonal arrays of
carbon atoms
– weak van der Waal’s forces between layers
– planes slide easily over one another -- good
lubricant
Adapted from Fig.
12.17, Callister &
Rethwisch 8e.
Chapter 12 - 22
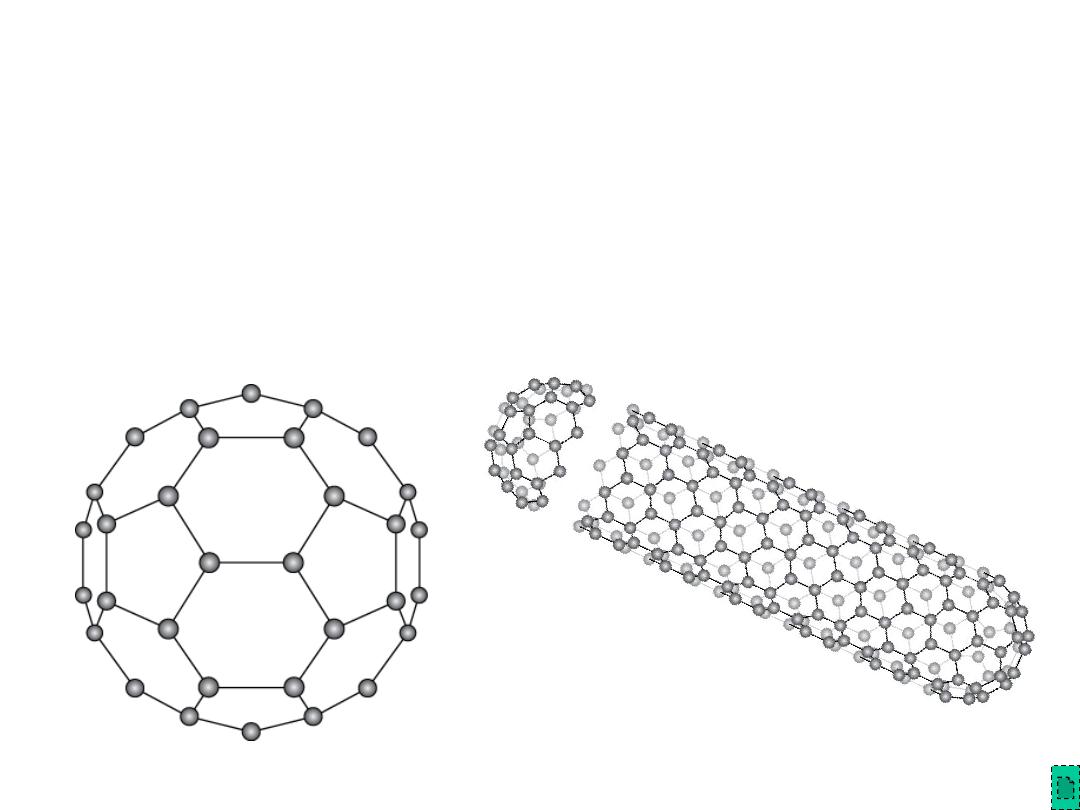
Polymorphic Forms of Carbon (cont)
Fullerenes and Nanotubes
• Fullerenes
– spherical cluster of 60 carbon atoms, C
60
– Like a soccer ball
• Carbon nanotubes
– sheet of graphite rolled into a tube
– Ends capped with fullerene hemispheres
Adapted from Figs.
12.18 & 12.19, Callister
& Rethwisch 8e.
Chapter 12 - 23
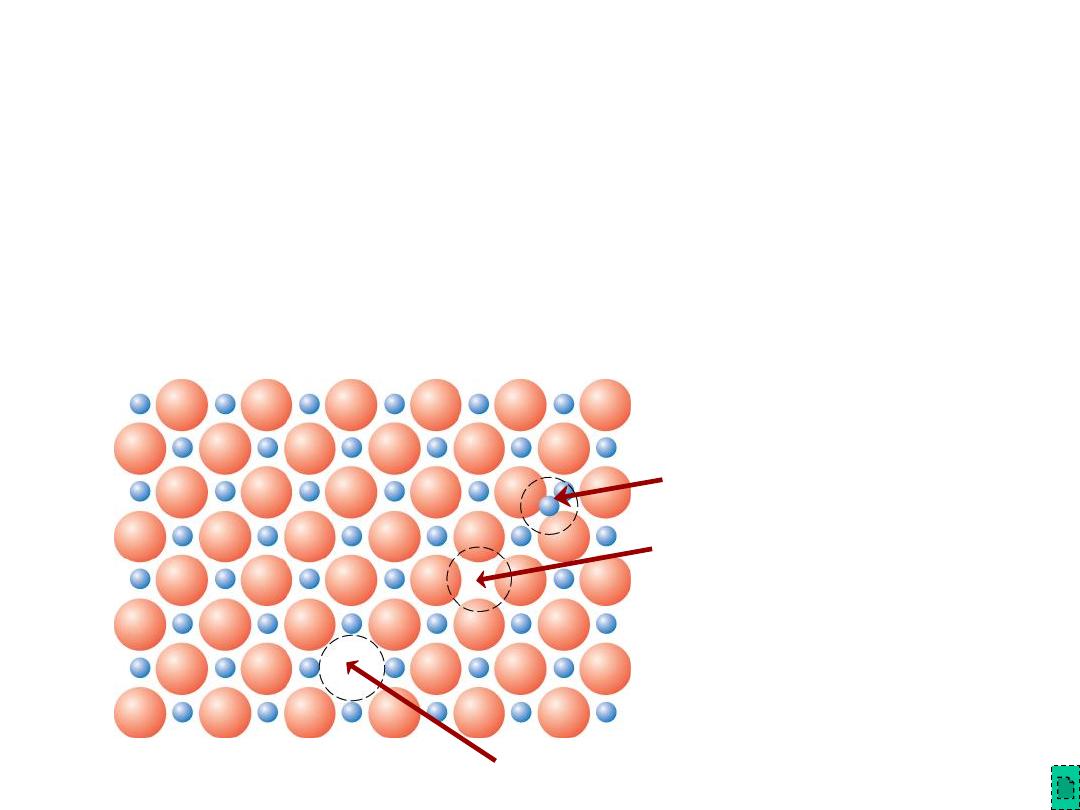
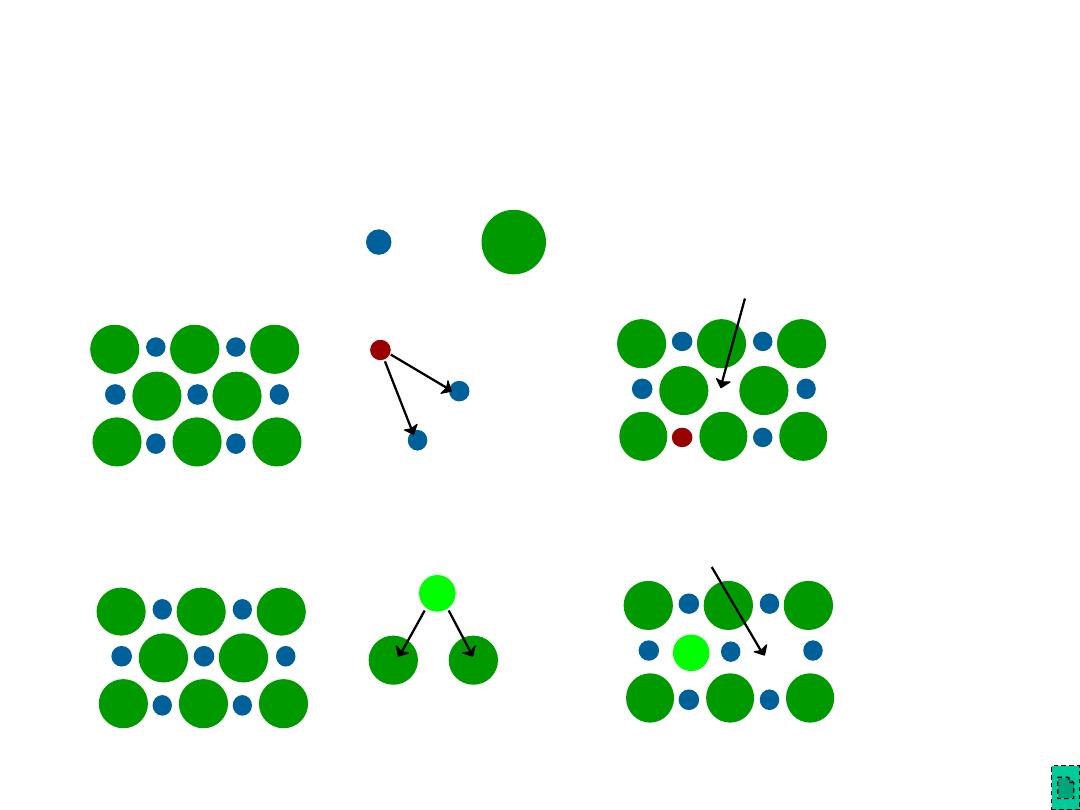
•
Vacancies
--
vacancies exist in ceramics for both cations and anions
•
Interstitials
--
interstitials exist for cations
-- interstitials are not normally observed for anions because anions
are large relative to the interstitial sites
Adapted from Fig. 12.20, Callister
& Rethwisch 8e. (Fig. 12.20 is
from W.G. Moffatt, G.W. Pearsall,
and J. Wulff, The Structure and
Properties of Materials, Vol. 1,
Structure, John Wiley and Sons,
Inc., p. 78.)
Point Defects in Ceramics (i)
Cation
Interstitial
Cation
Vacancy
Anion
Vacancy
Chapter 12 - 24
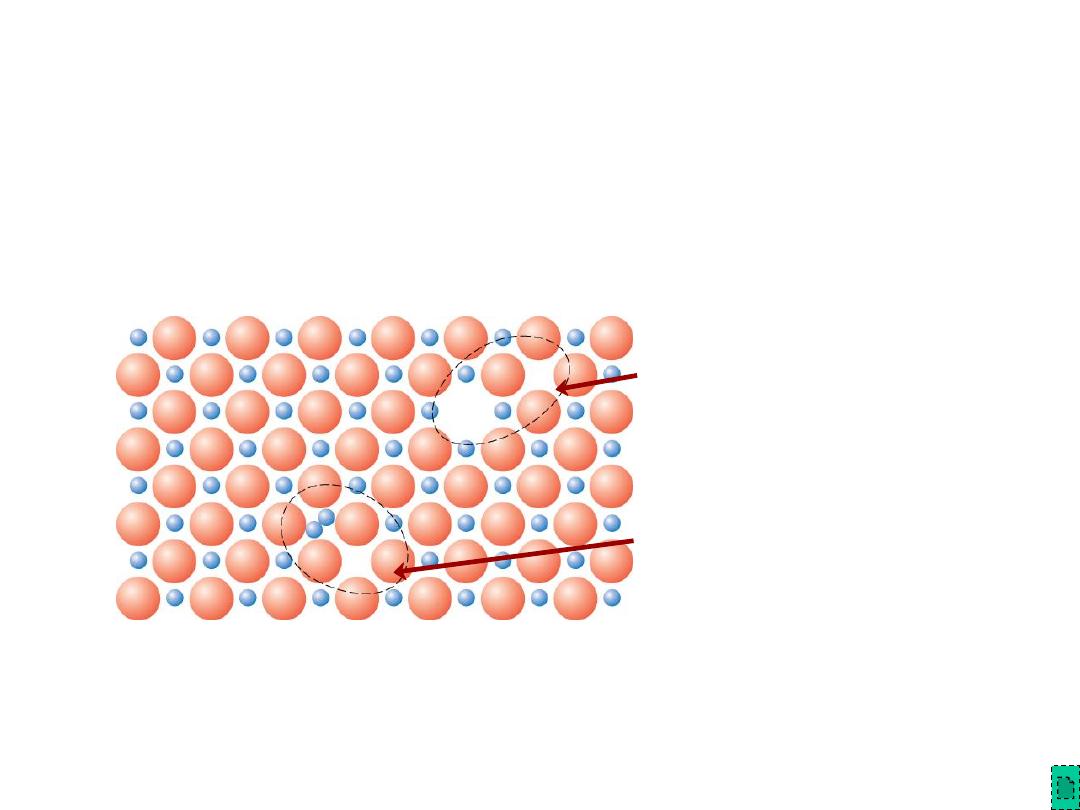
•
Frenkel Defect
--
a cation vacancy-cation interstitial pair
.
•
Shottky Defect
--
a paired set of cation and anion vacancies.
•
Equilibrium concentration of defects
Adapted from Fig.12.21, Callister
& Rethwisch 8e. (Fig. 12.21 is
from W.G. Moffatt, G.W. Pearsall,
and J. Wulff, The Structure and
Properties of Materials, Vol. 1,
Structure, John Wiley and Sons,
Inc., p. 78.)
Point Defects in Ceramics (ii)
Shottky
Defect:
Frenkel
Defect
/kT
Q
D
e
Chapter 12 - 25
•
Electroneutrality (
charge balance
) must be maintained
when impurities are present
•
Ex: NaCl
Imperfections in Ceramics
Na
+
Cl
-
•
Substitutional cation impurity
without impurity
Ca 2+ impurity
with impurity
Ca
2+
Na
+
Na
+
Ca
2+
cation
vacancy
•
Substitutional anion impurity
without impurity
O 2- impurity
O
2-
Cl
-
an ion vacancy
Cl
-
with impurity

Chapter 12 - 26
Mechanical Properties
Ceramic materials are more brittle than metals.
Why is this so?
• Consider mechanism of deformation
– In crystalline, by dislocation motion
– In highly ionic solids, dislocation motion is difficult
• few slip systems
• resistance to motion of ions of like charge (e.g., anions)
past one another
Chapter 12 - 27
•
Room T behavior is usually elastic, with brittle failure.
•
3-Point Bend Testing
often used.
-- tensile tests are difficult for brittle materials.
Adapted from Fig. 12.32,
Callister & Rethwisch 8e.
Flexural Tests
– Measurement of Elastic
Modulus
F
L/2
L/2
d
= midpoint
deflection
cross section
R
b
d
rect.
circ.
•
Determine elastic modulus according to:
F
x
linear-elastic behavior
d
F
d
slope =
3
3
4b d
L
F
E
d
=
(rect. cross section)
4
3
12 R
L
F
E
d
=
(circ. cross section)
Chapter 12 - 28
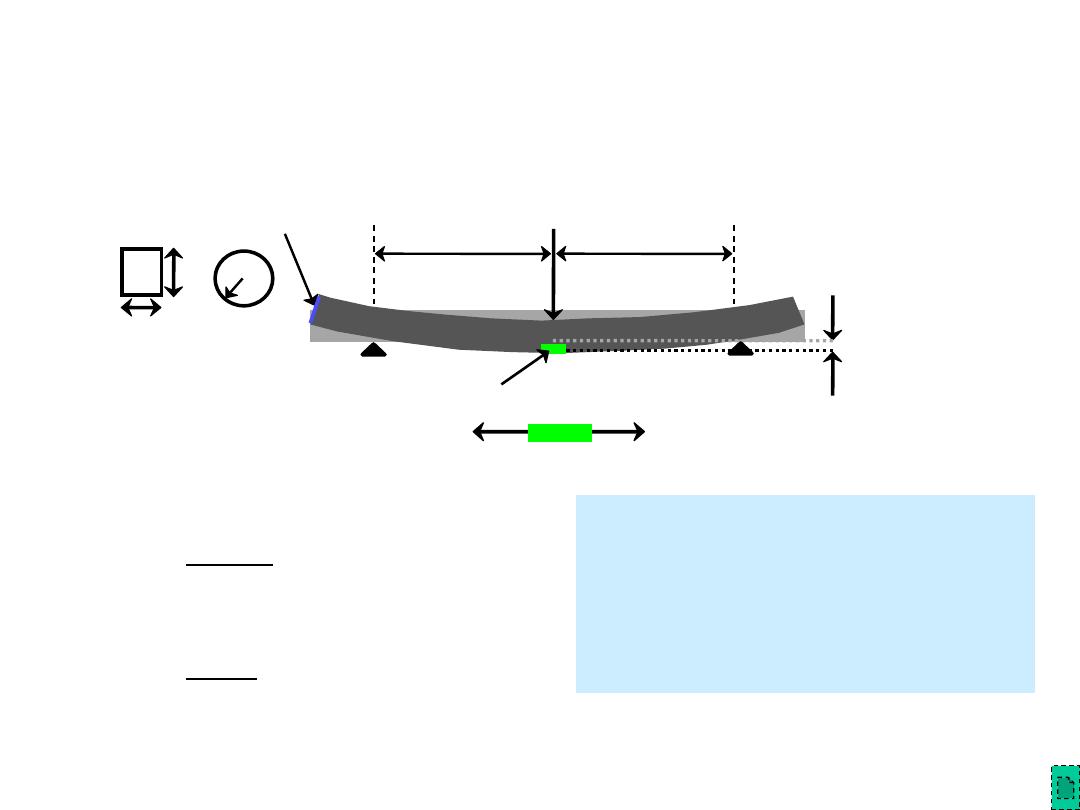
•
3-point bend test to measure room-T flexural strength.
Adapted from Fig. 12.32,
Callister & Rethwisch 8e.
Flexural Tests
– Measurement of Flexural
Strength
F
L/2
L/2
d
= midpoint
deflection
cross section
R
b
d
rect.
circ.
location of max tension
•
Flexural strength:
•
Typical values:
Data from Table 12.5, Callister & Rethwisch 8e.
Si nitride
Si carbide
Al oxide
glass (soda-lime)
250-1000
100-820
275-700
69
304
345
393
69
Material
s
fs (MPa) E(GPa)
2
2
3
b d
L
F
f
fs
=
s
(rect. cross section)
(circ. cross section)
3
R
L
F
f
fs
=
s

Chapter 12 - 29
SUMMARY
• Interatomic bonding in ceramics is ionic and/or covalent.
• Ceramic crystal structures are based on:
-- maintaining
charge neutrality
-- cation-anion radii ratios.
• Imperfections
-- Atomic point: vacancy, interstitial (cation), Frenkel, Schottky
-- Impurities: substitutional, interstitial
-- Maintenance of charge neutrality
• Room-temperature mechanical behavior – flexural tests
-- linear-elastic; measurement of elastic modulus
-- brittle fracture; measurement of flexural modulus
