1
ELECTROLYTES AND NONELECTROLYTES
Lec.3
By : Dr. Tamathir Abbas 6/12/2015
ELECTROLYTES AND NONELECTROLYTES
**Before we can discuss the properties that make a compound an electrolyte, we
must first understand something about the properties of electricity.
--Electricity is the flow of electrons in a circuit from a battery or electrical
generator along a wire back to the source. The electricity passing through the
circuit can do work, such as running a motor or providing heat and light. The flow
of electricity stops if the circuit is broken. An electrical circuit can also contain an
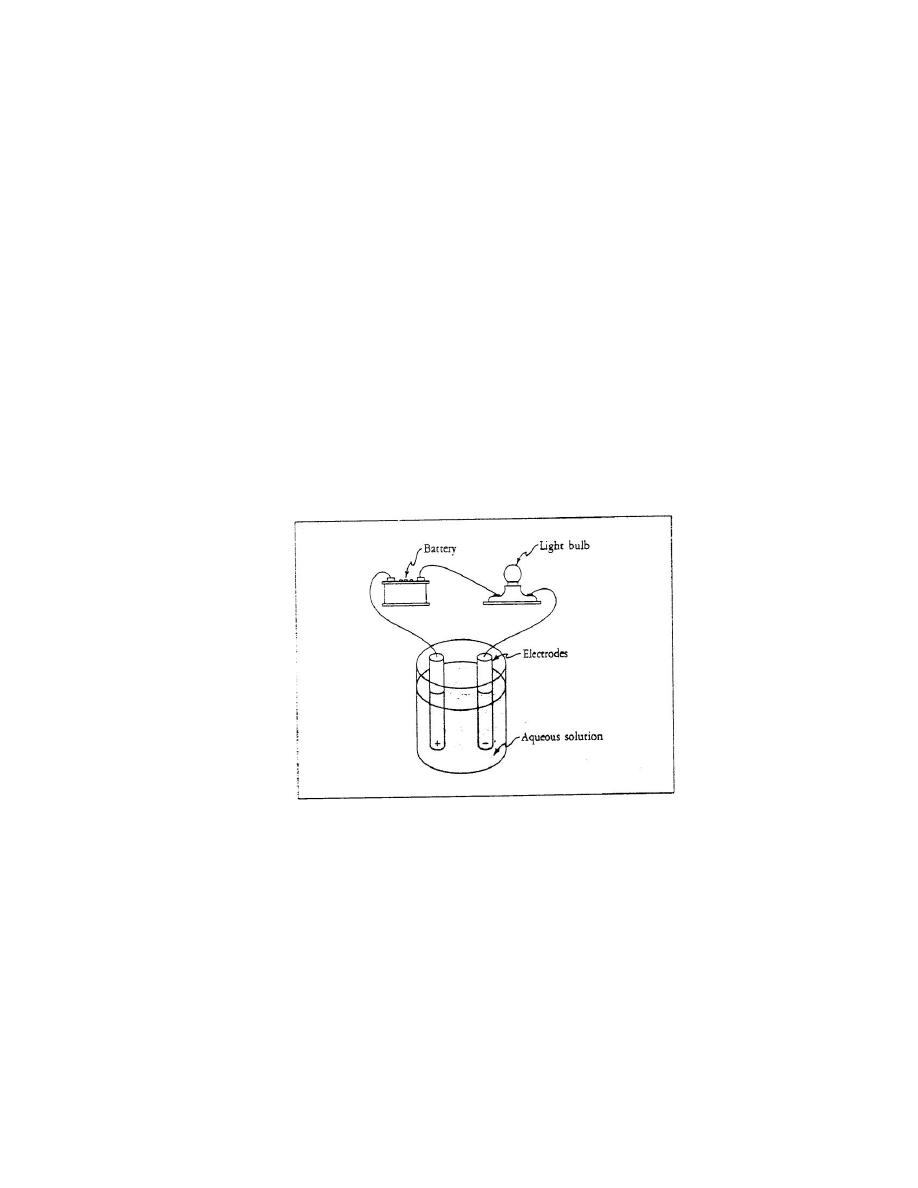
aqueous solution, as shown in Figure 8-2.
Fig. 8-2. An electrical circuit containing a battery, two electrodes, a light bulb,
and an aqueous solution. Wires connect the battery, the electrodes, and the light
bulb. The light bulb glows only if the aqueous solution conducts electricity.
--The two electrodes are oppositely charged, just like the two poles of the battery.
For electricity to flow through this circuit after all the connections have been made,
the solution must be able to conduct electricity. A glowing light bulb indicates that
electricity is flowing through the circuit.

2
** Aqueous solutions either conduct electricity or they do not. One that conducts
electricity is called an electrolytic solution; one that does not is called a
nonelectrolytic solution.
--A solute that forms an aqueous electrolytic solution is called an electrolyte.
♦ Example of electrolytes and nonelectrolytes are given in Table 8-4.
♣ In general, the extent to which an electrolyte can break up into ions categorises
an electrolyte. This gives a measure of the degree of dissociation (a) of an
electrolyte. Based on this degree the electrolytes can be classified as strong or
weak electrolyte and non-electrolyte.
1- Strong Electrolyte
A strong electrolyte dissociates or ionises completely or almost completely to
form free mobile ions in the solution or molten form. The more the availability of
free mobile ions in an electrolyte, the greater is its capacity to carry or conduct
current i.e. the stronger the electrolyte. The ability to conduct current can be
observed by setting up a cell as shown in figure 4.4. The bulb glows brightly.
For e.g.,
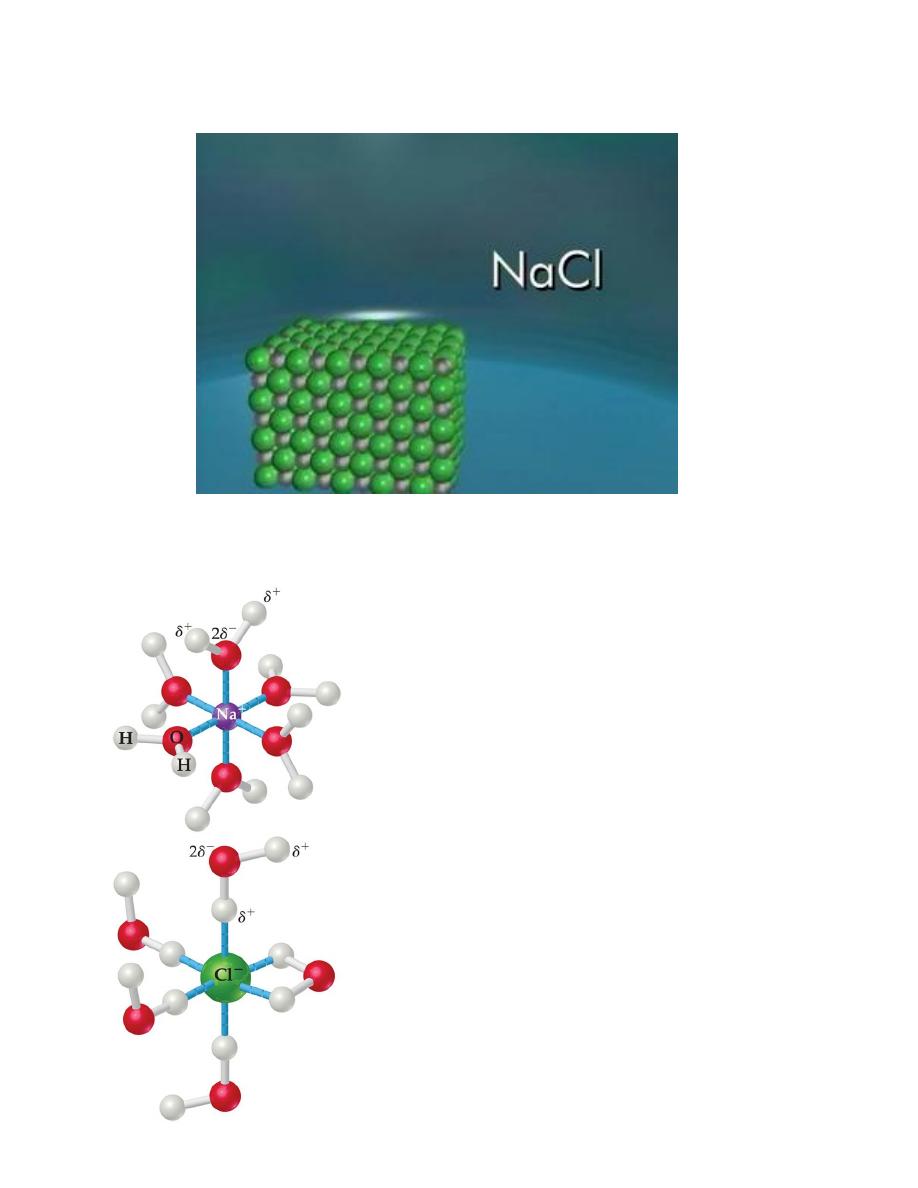
Sodium chloride even in crystalline form consists of ions. But the ions are not
mobile. When melted or dissolved in water, it dissociates completely into free,
mobile ions
3
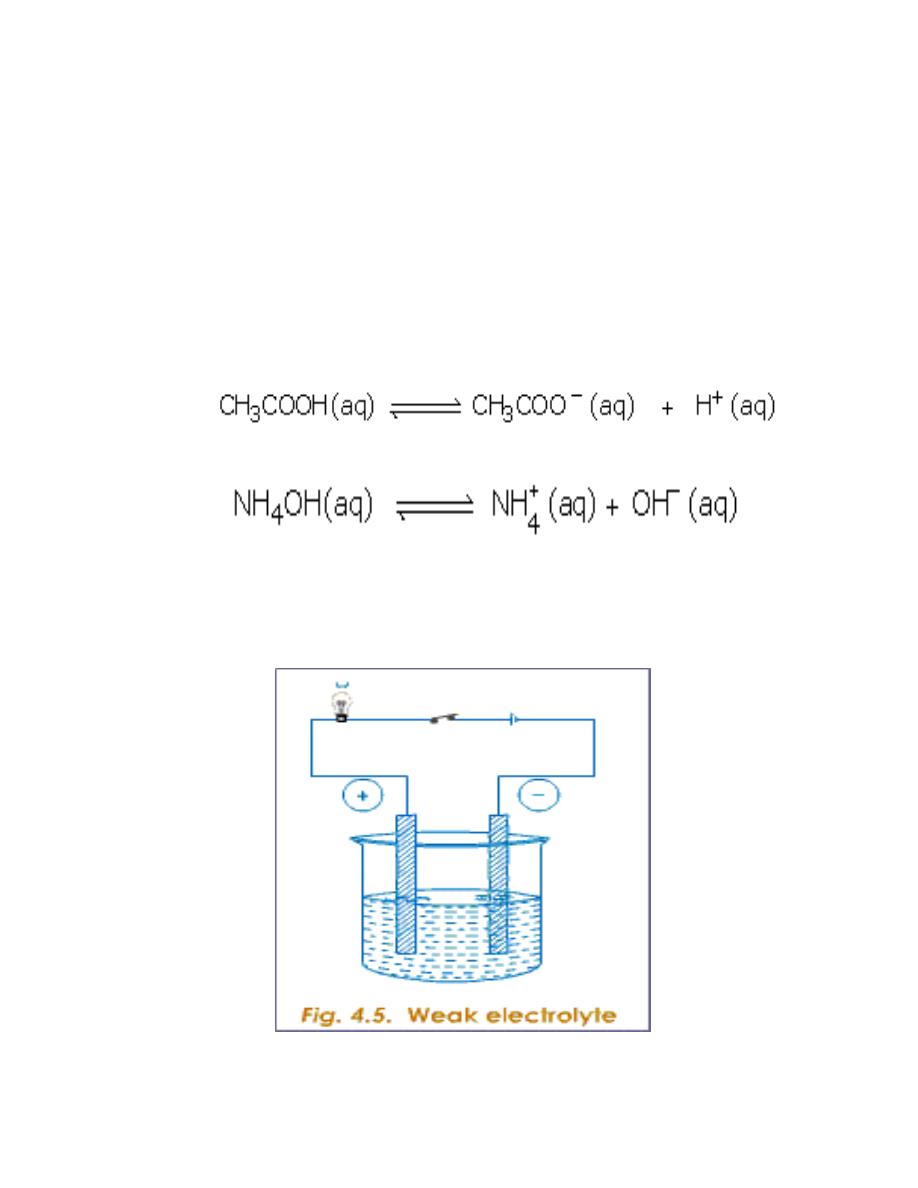
2-Weak Electrolyte
A weak electrolyte ionises or dissociates only partially to form free mobile
ions. Most of the electrolyte remains as un-ionised molecules.
--For example in acetic acid, the number of its dissociated ions (the acetate and
hydrogen ions) is less compared to the total amount of acetic acid molecules
present. Similarly in ammonium hydroxide the number of its dissociated ions (the
ammonium and hydroxyl ions) are less compared to the total amount of the
molecules present.
When the number of mobile ions is less in an electrolyte, the lesser is its capacity
to carry or conduct current i.e. the weaker is the electrolyte. This is observed by
setting up the cell as shown in figure 4.5. The bulb glows less brightly.

4
3- Non-electrolyte
A non-electrolyte does not provide ions in a solution and therefore current
does not flow through such solution. The bulb in the given set up does not glow
(Fig.4.6). Some examples of non-electrolytes are: alcohol, carbon tetrachloride,
carbon disulphide.
Examples of Electrolytes
Strong electrolyte
Weak
electrolyte
Non-electrolyte
Sea water
Tap water
Chemically pure
water
Hydrochloric acid
Carbonic acid
Alcohol
Sulphuric acid
Acetic acid
Kerosene
Aqueous copper sulphate
Ammonium
hydroxide
Aqueous sugar
solution
Molten lead bromide
Citric acid
Carbon disulphide
Aqueous sodium chloride
Oxalic acid
Nitric acid
Aqueous potassium
hydroxide

5
ARRHEIUS' THEORY OF ELECTROLYTES
In 1887the Swedish scientist
proposed that molecules
dissolve in water to form particles that mix completely with solvent molecules.
**Electrolytes and nonelectrolytes form different kinds of particles when they
dissolve in water.
1- All the electrolytes are compounds that contain ionic bonds. Such compounds
are solids at room temperature and contain ions arranged in a crystal lattice. When
these compounds are dissolves in water, the ions are released and they distribute
themselves uniformly in the water. In addition to salts, many compounds with
polar covalent bonds also form ions when dissolved in water.
2- When nonelectrolytes dissolve in water, neutral molecules rather than ions are
released. Pictorial representations of solutions of electrolytes and nonelectrolytes
are shown in Figure 5-3. Water molecules surround ions'. Such close association of
water molecules with an ion is called hydration. We say that the ion is hydrated.

6
Fig. 8-3. A pictorial representation of (a) an aqueous solution of an electrolyte and (b) an
aqueous solution of a nonelectrolyte. The open spheres represent water molecules. The spheres
containing a plus or minus sign represent the ions; the spheroids represent neutral molecules.
--According to Arrhenius' model, an aqueous solution of sodium chloride contains
an equal number of individual sodium and chloride ions, each surrounded by water
molecules.
--Thus, 1 mole of sodium chloride forms ,1 mole of sodium ions and 1 mole of
chloride ions when dissolved in water.
**Aqueous solutions of electrolytes are really solutions of hydrated ions. The total
number of ions formed per mole of electrolyte depends on the chemical formula of
the electrolyte, as shown in Table 8-5.
--Thus, 1 mole of calcium chloride dissolved in water forms 1 mole of hydrated
calcium ions and 2 moles of hydrated chloride ions.

7
--We can use Arrhenius' model to explain how solutions of electrolytes conduct
electricity. Let us return to the electrical circuit shown in Figure' 8-2.
**One of the two electrodes has a positive charge; the other has a negative charge.
The positive ions (cations) in an electrolytic solution are attracted to the negatively
charged electrode and move freely in that direction. The negative ions (anions) are
attracted to the positively charged electrode and move in that direction.
**This movement of ions in the solution results in a transport of electrical charge
from one electrode to the other. The net effect is a flow of electrons through the
solution. This is represented in Figure 8-4.

8
Fig. 8-4. The passage of an electric current through an electrolytic solution by the movement of
ions. The spheres containing a plus or minus sign represent ions.
♠The situation is different in an aqueous solution of sugar, a nonelectrolyte. The
sugar molecules, surrounded by water molecules, are neutral. When a pair of
electrodes is placed in this solution, the sugar molecules are not attracted by either
electrode. Consequently no electric current flows through the solution.
are substances that dissociate in water to yield electrically charged atoms
, one of which is a
+
).
ionize in water to yield
−
). It is now known that the
hydrogen ion cannot exist alone in water solution; rather, it exists in a combined
state with a water molecule, as the
3
O
+
). In practice the
hydronium ion is still customarily referred to as the hydrogen ion.
**We now have a model of electrolytic and nonelectrolytie solutions that we
have used to explain the difference in electrical conductivity between the two
types of solution. This model of solutions has been used successfully to explain
all the physical properties of solutions. Osmosis is one physical property of
solutions that is vital to the life of any cell. For this reason, we will examine
this physical property next.
9
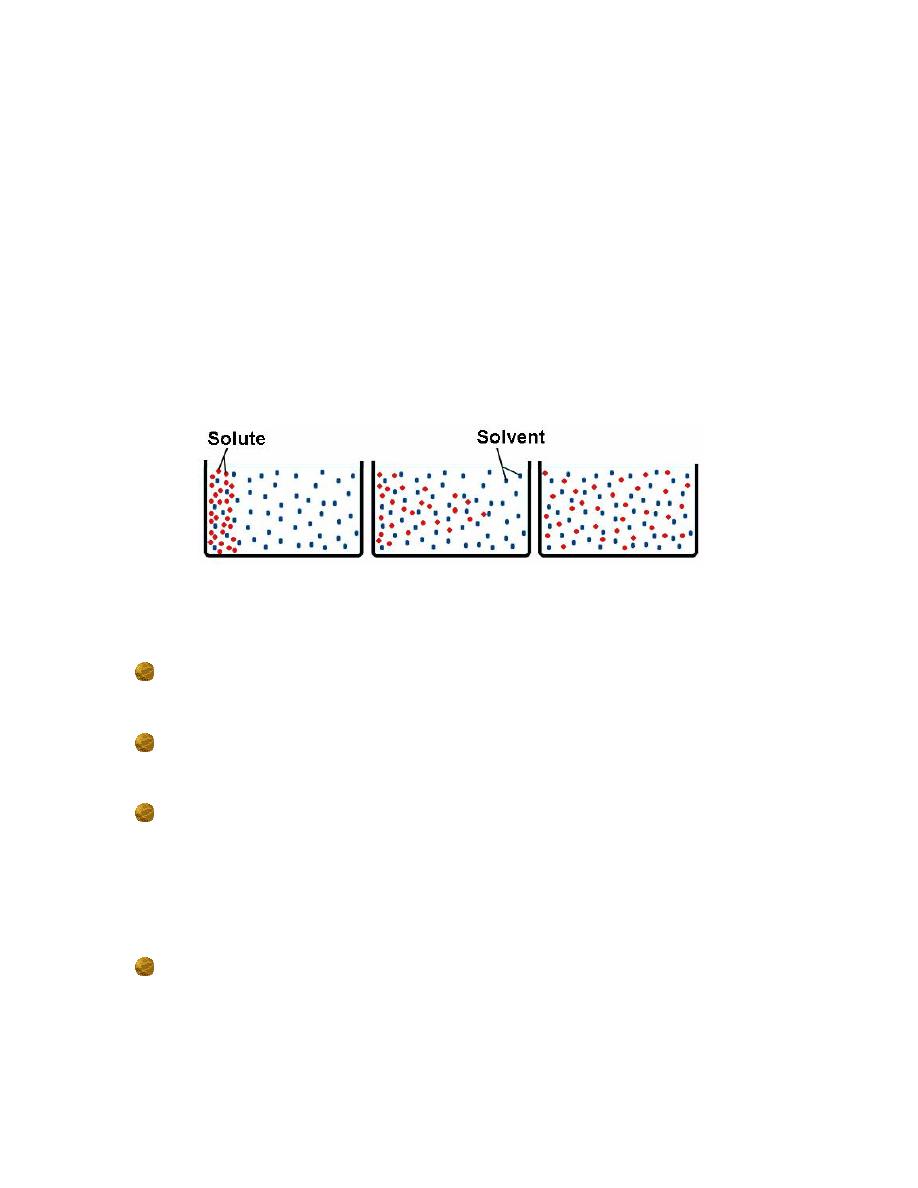
How Does a Solution Form?
☻The ions are solvated (surrounded by solvent).
☻If the solvent is water, the ions are hydrated.
☻The intermolecular force here is ion-dipole.

11
11
Diffusion
• Solute molecules moving from an area of high concentration to an area of
low concentration
– Random motion drives diffusion
– Movement is based on kinetic energy (speed), charge, and mass of
molecules
– Equilibrium is reached when there is an even distribution of solute
molecules
Osmosis
Semipermeable membranes allow some particles to pass through while
blocking others.
In biological systems, most semipermeable membranes (such as cell walls)
allow water to pass through, but block solutes.
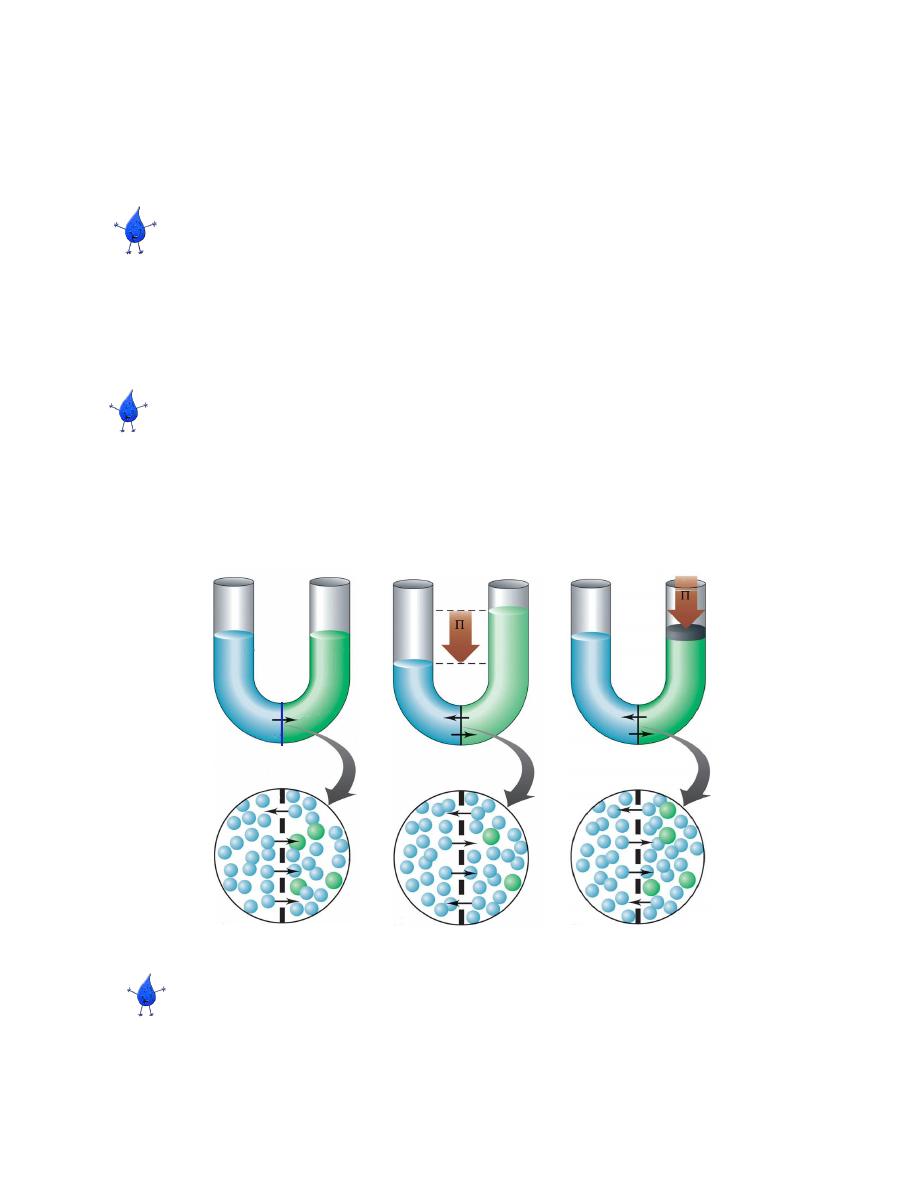
Osmosis can be demonstrated by use of the U-tube shown in Figure 8-5. We
place a thin membrane made of cellophane at the bottom of the U-tube. Pure
water is placed in one arm of the U-tube, and an aqueous solution of glucose
is placed in the other arm. We make sure that the heights of the columns in
both arms of the U-tube are equal (Figure 8-5a).
--Several hours later, we find that the height of the column of glucose
solution is greater than the height of the column of pure water (Figure 8-5b).
For this change to a occur, water must have passed through the membrane.

12
Materials that only certain molecules to pass through are called
semipermeable membranes or osmotic membranes.
--In our experiment, cellophane was the semipermeable membrane. In cells,
the semipermeable membrane is the plasma membrane mentioned earlier.
Osmosis
In osmosis, there is net movement of solvent from the area of higher
solvent concentration (lower solute concentration) to the are of lower
solvent concentration (higher solute concentration).
Water tries to equalize the concentration on both sides until pressure is
too high.
♦ There are microscopic pores in the membrane.
♦ Molecules below a certain size can diffuse through the pores.
♦ Water molecules can easily diffuse through the pores.
13
H.W : EXERCISE 8-13 Each of the following pairs of aqueous solutions is
separated by an osmotic membrane. In which direction will the water move? (a)
water, 1M NaCl (b) 1M glucose, 0.5 M glucose (c) 0.5 M NaBr, 1.0 M NaCl
We can prevent osmosis from occurring by applying pressure to the right arm
of the U-tube in Figure 8-5. If we apply just the right amount of pressure, we can
keep the heights of the columns in both arms equal and osmosis does not occur.
The pressure needed to prevent osmosis is called the osmotic pressure of a
solution.
Notice that a high solute concentration means high osmotic pressure. Water
moves from dilute to more concentrated solutions. The purpose of this movement
of water is to make the concentrations of the solutions equal.
Figure:
The development of osmotic pressure.
pure
solvent
solution
net movement of solvent
semipermeable
membrane
solvent
molecules
solute
molecules
osmotic pressure
Applied pressure
needed to prevent
volume increase
We must look at the structure of the osmotic membrane at the
molecular level to understand osmosis. An osmotic membrane contains

14
small holes. The size of these holes is an important property, which
determines what kinds of molecules will pass through the membrane.
♣Molecules larger than the holes will not pass through. The membrane
therefore acts like a molecular sieve. Certain molecules pass through the
membrane, and others do not. This selectivity of the membrane is
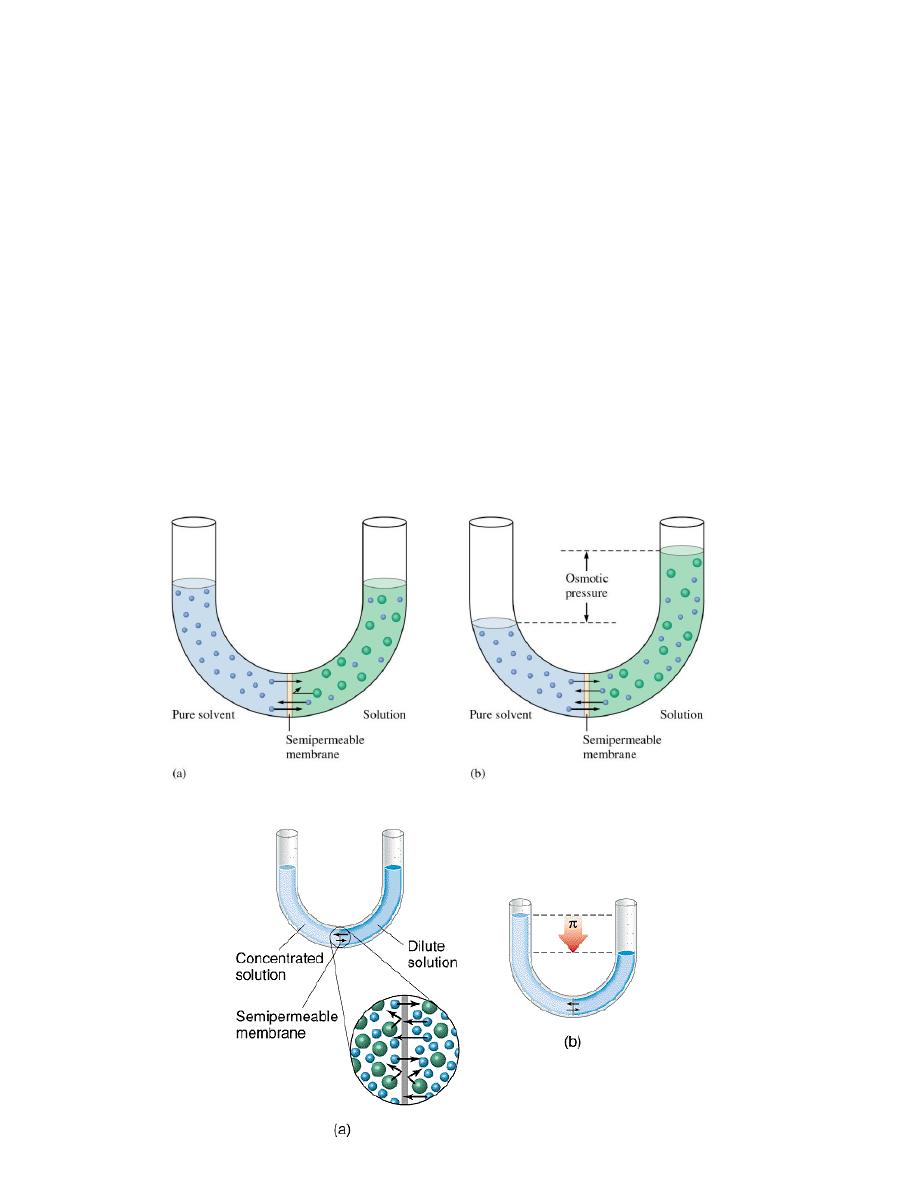
responsible for osmosis, as we will learn from the diagram in Figure 8-6.
☺Figure 8-6 shows a molecular view of two aqueous glucose solutions
of different concentrations separated by an osmotic membrane. The
more concentrated solution is in the right compartment. The holes in the
osmotic membrane are large enough that water molecules can pass in
both directions. But the holes are so small that glucose molecules cannot
get through. All the molecules in both solutions are in continual motion.
15
--As a result of this motion, water molecules reach the membrane and
collide with it. A water molecule that happens to find a hole in the
membrane passes through it.
☼The amount of water in the concentrated solution is less than that in
the dilute solution, so the number of water molecules that collide with
the membrane is smaller.
☻As a result, more water molecules pass through the membrane from
the dilute glucose solution to the more concentrated glucose solution.
The result is a net movement of water into the more concentrated
glucose solution. This is visible as an increase in its volume. As shown
in the following figure .
